抗体是由效应B细胞分泌的免疫球蛋白,有助于免疫系统识别和中和抗原或其他外来物质。1975年,科勒和米尔斯坦首先建立了杂交瘤技术。该技术在体外连续培养骨髓瘤细胞,融合能分泌抗体的B淋巴细胞,然后通过筛选克隆黄嘌呤氨基蝶呤胸苷获得大量的单克隆细胞株。这项技术为开发治疗性单克隆抗体奠定了基础。
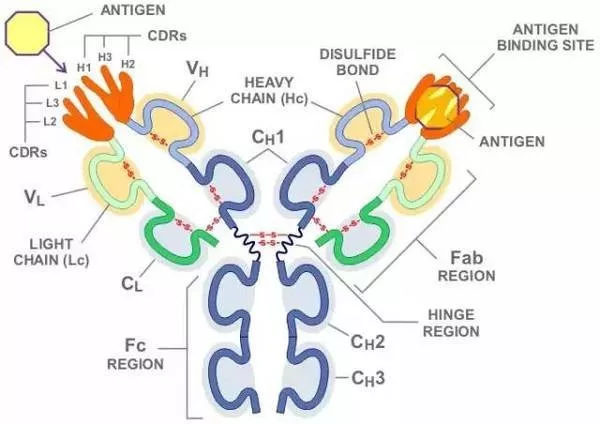
抗体是对称结构,有四条多肽链,其中两条是相对分子量更长更高的同一重链(H链);两条相同的轻链(L链),相对分子量短且低。这些链通过二硫键和非共价键连接,形成由四条多肽链组成的单体分子。轻链有、两种,重链有、、、、五种。整个抗体分子可分为两部分:恒定区和可变区。在给定的物种中,不同抗体分子的恒定区都具有相同或几乎相同的氨基酸序列。可变区位于“Y”的两个臂的末端。在可变区,少数氨基酸残基变化强烈,这些氨基酸残基的组成和排列顺序更容易发生变化的区域称为高变区。高变区位于分子表面,最多由17个氨基酸残基组成,最少只有2 ~ 3个氨基酸残基。高变区的氨基酸序列决定了抗体结合抗原的特异性。一个抗体分子上的两个抗原结合位点是相同的,它们在两臂的末端被称为抗原结合片段(Fab)。‘y’的梗叫做晶状片段(FC),糖和FC结合在一起。
单克隆抗体的发展经历了小鼠单克隆抗体、嵌合单克隆抗体、人源化单克隆抗体和全人类单克隆抗体四个阶段。
小鼠单克隆抗体(-omab,MoMcAb):小鼠杂交瘤单克隆抗体主要是将免疫小鼠的B细胞与骨髓瘤细胞融合,然后筛选出能无限增殖并分泌抗体的小鼠杂交融合细胞,再进行筛选、抗体制备和抗体纯化。
嵌合单克隆抗体(-ximab,昔单抗):是指将小鼠恒定区替换为小鼠单克隆抗体可变区序列的人鼠杂交抗体。它的研制程序快,能大大降低异源抗体的免疫原性,但几乎保留了亲本鼠单克隆抗体的全部特异性和亲和力。此外,它还具有人抗体的效应功能,如补体结合和抗体依赖性细胞介导的细胞毒性(ADCC)。
人源化单克隆抗体(-zumab,bead monoclonal antibody):利用大量已被详细分析的现有小鼠抗体,将与抗原直接接触的抗体片段(CDR)与人抗体框架进行嫁接。亲和力改造后,其特异性和大部分亲和力得以保持,而免疫原性和毒副作用几乎被去除。
人源单克隆抗体(-umab):抗体的可变区和恒定区为人,去除了免疫原性和毒副作用。人源抗体制备的相关技术主要有:人源杂交瘤技术、EBV转化B淋巴细胞技术、噬菌体展示技术、转基因鼠抗体制备技术和单个B细胞抗体制备技术等。
人源化和全人源化抗体制备的人源化和全人源化抗体药物具有高亲和力、高特异性和低毒副作用的特点,克服了动物抗体和嵌合抗体的缺点,成为治疗性抗体药物的必然趋势。
截至记者发稿时,FDA已经批准了50多种单克隆抗体药物,其中许多药物取得了超级大片的销量。以2017年发表的《单克隆抗体药物研究进展》号文章(作者赵晨曦等。),本文补充了各种单克隆抗体的国内申报情况和国内外市场情况。
1 靶向肿瘤相关分子单克隆抗体进展
迄今为止,肿瘤的治愈仍是临床治疗的一大挑战。当手术、放化疗无法控制肿瘤发展时,抗体成为肿瘤治疗的重要辅助手段。与传统药物相比,治疗性抗体不仅可以反复给药,而且具有靶向性高、毒副作用低、疗效好的特点。根据单克隆抗体的作用特点,从抑制肿瘤存活关键分子、激活免疫固定和抗肿瘤适应性、抗体与细胞毒药物偶联三个方面介绍了单克隆抗体在肿瘤治疗领域的应用。
1.1抑制肿瘤存活的关键分子
CD20
1.1.1.1概况
CD20是B淋巴细胞的表面标志,最初在Pro-B细胞(CD45R,CD117)中表达,随着B细胞的成熟,其表达增加。CD20在成熟浆细胞、正常造血干细胞和其他造血细胞系中不表达。因此,CD20已成为治疗B淋巴细胞白血病的分子药物靶点。
1.1.1.2代表毒品。
(1)利妥昔单抗,中国名利双收妥珠单抗,商品名Rituxan,利妥昔单抗。
由罗氏公司研发,1997年11月获FDA批准用于临床肿瘤治疗。利妥昔单抗是一种针对CD20的嵌合单克隆抗体,不仅能直接抑制B细胞增殖,诱导CD20细胞凋亡,还能通过ADCC和CDC杀伤肿瘤细胞。
根据罗氏2016年年报,2016年美乐总销售额达73亿瑞士法郎。
美罗华已获准进口。根据重庆最新中标信息,10mL:0.1g和50mL:0.5g规格的单价分别为3780元和17431.7元。
目前国内只有郑达田明申报了利妥昔单抗注射液,并于2016年9月4日获准临床使用。
Ibitumomab Tiuxetan,中文名为亚氨基妥珠单抗,商品名Zevalin。
由Spectrum Pharms公司开发,于2002年2月获得FDA批准。替米珠单抗是典型的放射性同位素缀合物。亚氨基妥珠单抗不仅能促进B细胞凋亡,还能招募放射性核素如粒子或粒子进入药物靶点,进一步增强对肿瘤细胞的杀伤作用。
该产品尚未进口到中国,进口的临床申请仍在审核中。没有国内企业的申请记录。
(3)Ofatumumab,中文名Ofatumumab,商品名Arzerra。
由诺华公司研发,2009年11月获得FDA批准,用于治疗慢性淋巴细胞白血病。tumumab的CD20结合表位与利妥昔单抗完全不同,具有更强的亲和力。它还通过ADCC和疾病预防控制中心采取行动。
诺华的年报没有披露这款产品的销售情况。
该产品尚未获准进口,其进口临床申请仍在审查中。没有国内企业的申报记录。
Obinutuzumab,商品名Gazyva。
罗氏研发的第一个型糖基化第二代全人抗CD20单克隆抗体于2013年11月获得FDA批准。
Obinutuzumab单克隆抗体属于无岩藻糖基抗体。在抗体制备过程中,N-乙酰氨基葡萄糖转移酶3和(Golgimannosidase 2)过量表达,降低了抗体的海藻糖含量,增强了ADCC效应。inutuzumab和CD20的结合表位与利妥昔单抗重叠,也能直接诱导细胞死亡。发现obinutuzumab对CLL和非霍奇金淋巴瘤(NHL)细胞具有比利妥昔单抗更强的抑制活性。
去年美国血液学会年会上公布的临床三期试验结果显示,Gazyva联合化疗治疗滤泡性淋巴瘤比利妥昔单抗更有效。此外,Gazyva在急性髓细胞白血病、多发性硬化和间皮瘤的治疗方面,以及罗氏和艾伯维为慢性淋巴细胞白血病开发的GAZYVA和Venclexta的组合方面,也取得了一些进展。
罗氏2016年年报没有披露这款产品的具体销量,但指出比2015年增长了52%。
Obinutuzumab尚未获准进口,但最近完成了进口临床应用的评估。没有国内企业的申报记录。
Ocrelizumab,商品名Ocrevus。
2017年3月,美国罗氏基因泰克公司的人源化抗体(90% ~ 95%人源化)上市,用于治疗多发性硬化症。与第一代抗CD20单克隆抗体利妥昔单抗相比,利妥昔单抗治疗效果明显,ADCC作用强,免疫原性低。用药间隔时间长的特点可以显著提高患者的依从性。
罗氏于2007年提交了该产品的临床申请,但评估程序于2009年终止。
HER2
1.1.2.1概况
HER2是一种具有酪氨酸激酶活性的跨膜糖蛋白,属于表皮生长因子受体(HER)家族成员之一。她的家庭包括HER 1(EGFR erbb 1)、HER 2(NEU erbb 2)、HER3(erbB3)和HER4(erbB4)。她的家族成员在细胞的生理过程中起着重要的调节作用,通常通过它们之间的配体结合或二聚体形成来介导信号转导。研究发现HER2不仅与肿瘤的发生发展密切相关,也是乳腺癌的重要预后指标。针对HER2的单克隆抗体可以下调HER2的表达水平,抑制肿瘤生长。
1.1.2.2代表毒品。
(1)曲妥珠单抗,中文名曲妥珠单抗,商品名赫赛汀(Herceptin)。
赫赛汀(Herceptin)是罗氏公司开发的人源化抗HER2抗体,于1998年11月获得FDA批准,它结合HER2,直接阻断表皮生长因子-HER2的信号转导通路,抑制肿瘤生长。
根据罗氏2016年年报,2016年该产品销售额为67.82亿瑞士法郎。
这种产品已获准进口。根据重庆2017年7月招标信息,该产品20mL:440mg价格为22907.2元。
华生物和天晴已获准临床应用。
(2)Pertuzumab,中文名Pertuzumab,商品名Perjeta。
由罗氏研发并于2012年6月获得FDA批准的人源化抗HER2用于治疗HER2阳性转移性乳腺癌。与HER2结合后,pertuzumab阻断HER2受体与其他HER家族受体的二聚化,从而抑制肿瘤生长和转移。
根据罗氏2016年年报,2016年该产品销售额为18.46亿瑞士法郎。
该产品尚未批准进口,但罗氏的进口临床申请已经批准临床使用。没有国内企业的申报记录。
血管内皮生长因子/血管内皮生长因子受体2
1.1.3.1概况
血管生长因子(VEGF)在诱导血管生成和形成、增强血管通透性、内皮细胞生长、促进细胞迁移和抑制细胞凋亡中起着关键作用。因此,VEGF及其受体VEGFR2成为肿瘤治疗的药物靶点。
1.1.3.2代表毒品。
(1)贝伐单抗,中文名贝伐单抗,商品名阿瓦斯丁。
由罗氏公司开发并于2004年5月获得FDA批准的靶向VEGF单克隆抗体用于治疗转移性结肠癌。重组人贝伐单抗IgG1含有VEGF-结合小鼠单克隆抗体的互补决定区和人抗体的框架结构区。此后,bezumab被广泛用于肺癌、乳腺癌、肾癌和年龄相关性黄斑变性等眼部疾病。
根据罗氏2016年年报,2016年该产品销售额为67.83亿瑞士法郎。
这种产品已获准进口。根据2017年7月重庆最新招标信息,4mL:100mg规格单价为5216.92元。
郑达天晴的临床申报已获准临床使用。
(2)Ramucirumab,中文名称为路雷单克隆抗体,商品名为Cyramza。
抗VEGFR2单克隆抗体由李来公司研发,2014年获得FDA批准。莫鲁珠单抗可以阻断配体VEGF-A、VEGF-C、VEGF-D与受体VEGFR2的结合,可以有效阻断肿瘤的血液供应,从而达到抑制肿瘤生长的目的。它主要用于治疗最常见和致命的晚期转移癌,包括胃癌、非小细胞肺癌和结直肠癌。
礼来公司的年报没有披露这款产品的具体销量。
李来公司的进口临床申请已获批准,无国内企业的申请记录。
表皮生长因子受体
1.1.4.1概况
EGFR属于她的家庭。EGFR不仅调节人体正常细胞生长,而且在肿瘤发生后促进肿瘤细胞增殖。表皮生长因子(EGF)和转化生长因子(TGF-)激活膜受体EGFR酪氨酸激酶,促进EGFR构象变化形成二聚体。激活的下游信号包括Ras、Raf和PI3K-AKT。临床研究发现,用抗体阻断EGFR可通过上述信号通路抑制肿瘤细胞如直肠癌引起的血管生成、肿瘤转移和耐药性。
1.1.4.2代表毒品。
(1)西妥昔单抗,中文名西妥昔单抗,商品名爱必妥。
由Merck & Renano Company开发并于2004年2月批准的嵌合IgG1用于治疗转移性结肠直肠癌、转移性非小细胞肺癌和头颈癌。西妥昔单抗不仅能阻断生长因子与EGFR的相互作用,还能直接阻断突变EGFR的配体非依赖性信号通路,从而达到抑制肿瘤发展的效果。
根据默沙东2016年年报,2016年该产品的销量为8.8亿欧元。
该产品未被批准进口,没有进口或国内申报记录。
Panitumumab,中文名Panitumumab,商品名Vectibix。
由Amgen公司开发并于2006年9月由FDA批准的完全人源化IG2用于治疗EGFR阳性转移性结肠癌。虽然IgG2帕尼珠单抗比IgG1西妥昔单抗更人性化,更容易结合EGFR,阻断EGF或TGF配体与EGFR的结合,抑制其酪氨酸激酶活性和肿瘤细胞增殖,但在转移性结肠癌的临床研究中并无明显差异。
根据安进2016年年报,2016年该产品全球销售额为6.11亿美元。
该产品尚未获准进口,但安进已完成在中国的临床试验。没有国内企业的申报记录。
(3)Ranibizumab,中文名为Leizumab,商品名为Lucentis。
雷单抗是第二代人源化抗VEGF重组鼠单克隆抗体片段,由可降低免疫原性的非结合人源化片段和鼠高亲和力抗原决定簇组成。Leizumab可以与所有活性形式的VEGF-A结合,阻止它们与VEGF R1和VEGFR2结合,从而减少血管内皮细胞的增殖,降低血管通透性,抑制血管生成。FDA批准其用于治疗眼科疾病,如新生血管性年龄相关性黄斑变性。
根据诺华和罗氏2016年年报,2016年该产品全球销售额为34.41亿美元。
这种产品已获准进口。根据2017年10月重庆最新招标信息,该产品0.2mL规格单价为7125元。
上海联塞尔的新药临床应用仍处于评估阶段。
CD19
1.1.5.1概况
CD19、CD21和CD81都是B淋巴细胞的特异性表面标志,常用作B淋巴细胞白血病的诊断标志。发现淋巴细胞根据不同的抗原表达水平进行增殖和分化。低亲和力抗原受体帮助B细胞维持对各种抗原的特异性和敏感性。CD19从最早可识别的B谱系细胞到B细胞母细胞维持其表达,直到成熟浆细胞消失。
1.1.5.2代表毒品。
Blinatumomab,中文名Bonatuzumab,商品名Blincyto。
由Amgen公司研发,于2014年12月获得FDA批准,用于治疗费城染色体阴性复发性急性淋巴细胞白血病。Blinatumomab是一种针对CD19/CD3双靶标的小鼠双特异性抗体。通过B细胞的CD19识别位点和T细胞的CD3识别位点,在B淋巴肿瘤细胞周围募集大量肿瘤患者自身的T细胞,激活T细胞发挥细胞毒作用。
根据安进2016年年报,2016年该产品全球销售额为9000万美元。
该产品未批准进口,没有国内和进口申报记录。
CD25
1.1.6.1概况
CD25是由IL2RA基因编码的IL-2受体的链。高亲和力IL-2受体由链(IL2RA)、链(IL2RB)和链(IL2RG)组成。链同型二聚体形成中等亲和力的IL-2受体;链同型二聚体形成低亲和力IL-2受体。CD25通常在活化的T、B细胞、一些胸腺细胞和骨髓祖细胞中表达。CD25已经成为小鼠CD4 FoxP3 Treg细胞的表面标记。然而,大多数静息记忆T细胞被发现在人体内组成性表达CD25。CD25在大多数B淋巴瘤、一些急性非淋巴细胞白血病、神经母细胞瘤、肥大细胞增多症和肿瘤浸润淋巴细胞中表达,并可作为人T淋巴细胞白血病病毒型的受体发挥作用。
1.1.6.2代表毒品。
Dazumab,中文名Dazuzumab,商品名Zenapax。
由BiogenIdec和AbbVie公司开发并于1997年获得FDA批准的人源化单克隆抗体,用于预防肾移植患者对环孢素和糖皮质激素的急性排斥反应。但在应用过程中发现,至少有10%的患者出现失眠、震颤、头痛、动脉高血压、呼吸困难、胃肠道不良反应和水肿等症状。在极少数情况下,药物会导致严重的过敏反应。由于市场需求不足,2009年停止了Zenapax在肾抑制患者急性排斥反应中的应用。2016年,FDA在采用新的商品名Zinbryta后,批准用于治疗成人复发性多发性硬化症。
该产品尚未批准进口,暂时没有国产和进口申报记录。
SLAMF7
1.1.7.1概况
膜蛋白slamf7(信号淋巴细胞激活分子F7)/cd319/cracc (Cd2样受体激活细胞毒细胞)属于信号淋巴细胞激活分子家族,最早发现参与自然杀伤细胞(NK细胞)的粘附功能。与正常浆细胞相比,许多免疫细胞,包括NK细胞、NK样T细胞、CD8 T细胞、活性单核细胞和树突状细胞,都低表达SLAMF7。2008年的一项研究发现,SLAMF7在多发性骨髓瘤患者的浆细胞中高表达。
1.1.7.2代表毒品。
Elotuzumab,中文名etotuzumab,商品名Empliciti。
由施贵宝和艾伯维共同研发的人源化单克隆抗体,2015年获得FDA批准,被Revlimid/地塞米松批准用于治疗复发性多发性骨髓瘤。Elotuzumab不仅可以通过ADCC靶向肿瘤细胞,还可以激活NK细胞,最终杀死多发性骨髓瘤。目前,多项临床试验正在评估elotuzumab在多发性骨髓瘤的前期治疗、中期维持和疾病复发中的治疗效果。在最受期待的III期临床试验Check Mate 602(NCT02726581)中,PD-1抗体nivolumab与elotuzumab和地塞米松联合治疗复发性多发性骨髓瘤。
根据施贵宝和艾伯维2016年年报,2016年该产品全球销售额为1.38亿元。
该产品尚未批准进口,暂时没有国内和进口申报记录。
CD38
1.1.8.1概况
包括CD4 T细胞、CD8 T细胞、B细胞和NK细胞在内的多种免疫细胞表达膜糖蛋白CD38。CD38在细胞粘附和钙信号转导中起关键作用。CD38催化环状ADP-核糖(cADPR)的合成和降解。CADPR作用于兰尼碱受体(RyRs)并参与细胞内钙库的钙动员。研究表明,CD38/cADPR通过RyRs通道介导的Ca2释放和Ca2信号传递,在调节Ca2内平衡中发挥重要作用。CD38分子是慢性B淋巴细胞白血病的预测因子和自身免疫性糖尿病的诊断指标。它还可以用于检测艾滋病和巨细胞病毒,并监测系统性红斑狼疮的病情。
1.1.8.2代表毒品。
Daratumumab,中文名dalemumab,商品名Darzalex。
强生公司研发并于2015年获得FDA批准的全人抗CD38抗体被批准用于已使用3种以上疗法的复发耐药多发性骨髓瘤患者。2016年,它被批准联合使用来那度胺(或硼替佐米)和地塞米松来治疗使用超过一种疗法的多发性骨髓瘤患者。发现daratumumab可以通过ADCC和CDC杀死肿瘤细胞。
根据强生2016年年报,2016年该产品全球销售额为5.21亿美元。
1.2激活免疫固定和抗肿瘤适应性。
肿瘤坏死因子-
1.2.1.1概况
TNF-是急性炎症反应时释放的细胞因子,由活化的单核细胞和巨噬细胞分泌,在炎症反应和细胞存活的调节中起关键作用。适量的TNF-有助于肿瘤的预防和病原菌的抵抗,但过量的TNF-可能引起各种病理损伤,促进肿瘤的发生发展。
1.2.1.2代表毒品。
(1)英夫利昔单抗,中文名英夫利昔单抗,Remicade。
1998年,FDA批准了高度特异性的阻断性TNF-嵌合抗体用于治疗克罗恩病、溃疡性结肠炎、银屑病、银屑病关节炎、强直性脊柱炎和类风湿性关节炎。
根据强生和默沙东2016年年报,2016年该产品全球销售额为81.44亿美元。
这种产品已获准进口。根据2017年7月重庆招标信息,该产品0.1g规格单价为6071元。
没有国内企业的申报记录。
(2)阿达木单抗,中文名阿达木单抗,商品名Humira。
美国雅培公司联合研发的全人抗体,用于治疗类风湿性关节炎和强直性脊柱炎。英夫利昔单抗和阿达木单抗均可中和血液中游离TNF-和免疫细胞表面跨膜TNF-的活性,阻断TNF-与型TNF-受体p55和型TNF-受体p75亚单位的结合。
根据雅培2016年年报,2016年该产品全球销售额为181.37亿美元。
这种产品已获准进口。根据2017年7月重庆最新招标信息,该产品0.8ml:40mg单价为7783元。
华基因、天晴、通化东宝均已获批临床应用。
(3)Certolizumab pegol,中文名西妥昔单抗,商品名Cimzia。
由UCB公司研发,2008年获得FDA批准,用于治疗克罗恩病、类风湿性关节炎、银屑病关节炎和强直性脊柱炎。赛珠单抗是人源化抗体Fab片段的聚乙二醇化TNF-抑制剂。
根据UCB 2016年年报,2016年该产品全球销售额为16.38亿元。
该产品未批准进口,没有国产和进口产品的申报记录。
Golimumab,中文名Golimumab,商品名Simponi。
人源化抗体由强生公司联合研发,2009年获得FDA批准,用于治疗关节炎、银屑病关节炎和强直性脊柱炎。从用人TNF-免疫的humab(Medarex)转基因小鼠产生的杂交瘤克隆中分离出Limumab。
根据强生2016年年报,2016年该产品全球销售额为22.44亿元。
该产品未批准进口,强生公司于2014年获批临床试验;2015年年报于近日获批临床。
没有国内企业的申报记录。
1.2.2白介素-6和白介素-6R
1.2.2.1概况
白细胞介素-6(IL-6)是一种多功能细胞因子,具有促进和抑制炎症反应的双重功能,在多种疾病的发生发展中起着关键作用。在组织损伤和细菌感染期间,T细胞和巨噬细胞释放大量的IL-6来刺激免疫反应。另一方面,IL-6可以通过抑制TNF-和IL-1,激活IL-1Ra和IL-10来抑制炎症。发现IL-6与IL-6R链(CD126)结合,CD126与信号转导成分gp130(CD130)共同形成细胞表面I型细胞因子受体复合物,通过JAK-STAT信号转导通路激活下游信号。除了膜结合受体,细胞因子IL-6也以可溶性IL-6R(sIL-6R)的形式存在。结果发现,虽然神经元细胞对IL-6刺激没有反应,但sIL-6R调节突触的生长,促进神经元的存活。
1.2.2.2代表毒品。
(1)tocilizumab,中文名为toclizumab,商品名为Actemra。
针对IL-6R的人源化抗体,由罗氏研发,2010年获得FDA批准,用于治疗类风湿性关节炎和全身性幼年特发性关节炎。
根据罗氏2016年年报,2016年该产品全球销售额为16.08亿美元。
这种产品已被批准进口。根据重庆最新招标信息,这款4ml:80mg规格的产品单价为1925元。
没有国内企业的申报记录。
(2)西妥昔单抗,中文名西妥昔单抗,Sylvant。
2014年,让桑公司生产的嵌合单克隆抗体西妥昔单抗以细胞因子IL-6为靶点,治疗艾滋病病毒和人类疱疹病毒-8(HHV-8)等疾病。Siltuximab阻断IL-6与可溶性和细胞膜型IL-6R的结合,并抑制B淋巴细胞和浆细胞的增殖、VEGF分泌和IL-6介导的自身免疫的发生。
根据强生2016年年报,2016年该产品全球销售额为1273万美元。
这种产品已获准进口。根据2017年7月重庆最新招标信息,该产品20ml:0.1g单价为4427元。
1.2.3 IgE
1.2.3.1概况
IgE是过敏反应的关键因素,主要由呼吸道和消化道粘膜固有层的淋巴组织B细胞分泌合成。阻断IgE合成和IgE炎症反应途径已成为抗过敏和抗哮喘的潜在药物靶点。
1.2.3.2代表毒品。
Omalizumab,中文名omalizumab,商品名Xolair。
诺华公司研发的人源化抗IgE抗体用于治疗哮喘、荨麻疹、湿疹等过敏性疾病。Omalizumab降低血浆游离IgE水平,阻断IgE与肥大细胞和嗜碱性粒细胞上IgE受体的结合,从而获得治疗效果。在临床应用中,发现该抗体具有良好的安全性和耐受性。
根据诺华2016年年报,该产品全球销售额为23.78亿美元。
该产品尚未批准进口,但诺华的临床应用已获批准。没有国内企业的申报记录。
1.2.4 RANKL
1.2.4.1概况
型膜蛋白RANKL是肿瘤坏死因子超家族成员之一,在骨骼肌、胸腺、肝脏、结肠、小肠、肾上腺、成骨细胞、乳腺上皮细胞、前列腺和胰腺中均有表达。RANKL参与细胞凋亡,并通过免疫系统调节骨再生和骨重建。
1.2.4.2代表毒品。
Denosumab,中文名dinotuzumab,商品名Prolia。
Amgen公司研发的全人单克隆抗体,于2010年获得FDA批准,可抑制破骨细胞的活化和发育,减少骨吸收,增加骨密度,用于治疗绝经后骨质疏松症。与其他RANKL抑制剂相比,denosumab能在较低浓度下产生药效,具有作用时间长、无自身免疫排斥反应的特点。临床研究发现,denosumab可在12小时内起效,半衰期约32天,个别患者疗效可长达6个月。
根据安进2016年年报,2016年该产品全球销售额为31.6亿美元。
该产品尚未批准进口,没有国内外企业的申报记录。
1.2.5白介素-12/白介素-23
1.2.5.1概况
细胞因子IL-12在Th1细胞介导的炎症免疫反应中起关键作用。细胞因子IL-23也属于IL-12家族,与IL-12共享p40亚单位。斑块型银屑病是一种自身免疫性疾病,主要表现为炎性斑块和鳞屑性皮肤,并伴有IL-12、IL-23等细胞因子的异常升高。
1.2.5.2代表毒品。
Ustekinumab,商品名Stelara。
靶向p40亚单位并阻断IL-12/IL-23细胞因子效应的全人单克隆抗体由强生公司研发,2008年获得FDA批准。它被用来治疗中度至重度斑块型银屑病。2013年增加了治疗寻常型银屑病的新适应症。
根据强生2016年年报,2016年该产品全球销售额为33.32亿美元。
该产品尚未批准进口,没有国内和进口申报记录。
Guselkumab是2017年FDA批准的第二个同类单克隆抗体。
白细胞介素-1
1.2.6.1概况
IL-1调节炎症免疫反应,过度激活的IL-1也会引起免疫系统疾病。
1.2.6.2代表毒品。
卡纳基努玛,商品名伊拉里斯。
诺华公司研发的靶向IL-1的全人单克隆抗体药物,于2009年获得FDA批准,用于治疗与cryopyrin蛋白相关的周期性综合征(CAPS)。2016年,FDA添加该抗体的三种罕见的严重自身炎症疾病适应症包括肿瘤坏死因子受体相关循环综合征(TRAPS)、高免疫球蛋白D综合征(HIDS)/甲羟戊酸激酶缺乏症(MKD)和地中海热(FMF)。卡那单抗在皮下注射后7天左右达到最高血药浓度,绝对生物利用度达到70%。抗体主要通过受体介导的胞饮作用或液相内吞作用代谢,半衰期约为
白细胞介素-5
1.2.7.1概况
细胞因子IL-5调节嗜酸性粒细胞的生长、活化和存活。IL-5在嗜酸性粒细胞从骨髓向肺和其他器官的迁移中起着关键作用。
1.2.7.2代表毒品。
(1)美泊利珠单抗,中文名美泊利珠单抗,商品名纽卡拉。
葛兰素史克公司研发并于2015年获得FDA批准的针对IL-5的全人源化单克隆抗体用于治疗重度嗜酸性粒细胞性哮喘。美泊利珠单抗直接与细胞因子IL-5结合,阻断IL-5与嗜酸性粒细胞表面IL-5受体的结合,降低组织、血液和痰液中嗜酸性粒细胞的水平及其介导的炎症反应。皮下注射美泊利珠单抗的生物利用度可达80%,约4 ~ 8天可达最高血药浓度。
葛兰素史克2016年年报显示,2016年该产品全球销售额为1.27亿美元。
该产品尚未批准进口,但葛兰素史克的进口临床申请已获批准。
(2)reslizumab,商品名Cinqair。
蒂瓦公司研发的靶向IL-5的全人单克隆抗体,于2016年获得FDA批准,用于治疗嗜酸性哮喘。临床应用表明,reslizumab能减轻重度嗜酸性粒细胞性哮喘的加重,改善肺功能,减轻哮喘。常见的不良反应包括血液中肌酸磷酸激酶升高、肌痛和过敏反应。Mepolizumab和reslizumab被蛋白水解酶降解和代谢,它们的生物半衰期分别为20天和24天。
没有该产品的销售信息。
该产品尚未批准进口,没有国内和进口申报记录。
1.2.8 47
1.2.8.1概况
整合素是淋巴细胞肠道迁移的关键蛋白,在肠道疾病的发生发展中起着关键作用。
1.2.8.2代表毒品。
Vedolizumab,vitozomab,Entyvio。
日本武田制药研发的靶向47的人源化单克隆抗体,2014年获得FDA批准,用于中重度传染性法氏囊病(IBD),后期增加了溃疡性结肠炎(UC)、克罗恩病(CD)等新适应症。Vedolizumab可通过结合淋巴细胞47整合素阻止淋巴细胞迁移至肠组织。与4那他珠单抗不同,vedolizumab不能阻止淋巴细胞迁移到中枢神经系统。因此,在临床应用中不会出现乳真空JC病毒介导的进行性多灶性脑白质病。Vedolizumab引起严重感染的比例较低,因此在应用前无需筛查结核病毒和乙肝病毒。
根据武田制药2016年年报,2016年该产品全球销售额为11.5亿元。
该产品尚未批准进口,武田制药的进口临床申请已获批准。没有国内企业的申报记录。
1.2.9巴富布
1.2.9.1概况
细胞因子(BAFF)在维持B细胞的发育和存活中起着关键作用。研究发现,系统性红斑狼疮发生过程中BAFF表达的异常增加引起自身免疫B细胞的异常增殖,进而促进SLE的发展。
1.2.9.2代表毒品。
贝利穆单抗,商品名Benlysta。
葛兰素史克公司研发的靶向BAFF单克隆抗体于2011年获得FDA批准,成为56年来首个治疗SLE的药物。贝利单抗可阻止BAFF激活B细胞,导致SLE患者B细胞凋亡,有效防止SLE患者B细胞引起的自身免疫损伤。
葛兰素史克2016年年报显示,2016年该产品全球销售额为4.48亿美元。
该产品尚未批准进口,但葛兰素史克的进口临床申请已获批准。
1.3抗体偶联细胞毒性药物(ADC)
概述
ADCs (Anti-body-drug conjugate)是一种将化疗药物与抗体偶联的药物,可以杀死肿瘤细胞,不良反应较少。恩坦辛(DM1)和MMAE是两种常用的联合化疗药物。
1.3.2代表毒品。
(1)ado-trastuzumab emtansine,商品名Kadcyla。
2013年,基因泰克研发的细胞毒剂DM1通过曲妥珠单抗(赫赛汀)靶向HER2。Kadcyla不仅通过曲妥珠单抗阻断HER2/neu受体的同二聚化或异二聚化,而且抑制其介导的信号转导通路。同时,DM1进入细胞后与微管蛋白结合,抑制肿瘤细胞的生长。Kadcyla主要用于治疗晚期HER2阳性转移性乳腺癌。常见的不良反应包括恶心、疲劳、血小板减少和肌肉骨骼疼痛。临床研究发现,Kadcyla不仅为HER2阳性乳腺癌患者提供了更长的无进展生存期,而且只有单独使用赫赛汀和DM1的一半严重不良反应。
根据罗氏2016年年报,2016年该产品全球销售额为7.47亿美元。
该产品尚未批准进口,没有国内和进口申报记录。
Brentuximab vedotin,商品名Adcetris。
该产品是与抗CD30抗体和MMAE偶联的药物。2011年,它被批准用于治疗霍奇金淋巴瘤(HL)和一种罕见的系统性间变性大细胞淋巴瘤(ALCL)。针对特定抗肿瘤蛋白的单克隆抗体联合细胞毒药物将成为未来ADC的发展趋势。许多研究发现,这些专门针对肿瘤细胞的ADC具有很好的治疗效果。例如,用于乳腺癌和黑色素瘤的Glembatumumab Vedotin(抗hpnmbadc),用于慢性淋巴细胞白血病的cituzumab vendotin(抗ROR1ADC)。
根据武田制药2016年年报,2016年该产品全球销售额为1.73亿美元。
该产品尚未批准进口,没有国内和进口申报记录。
2 靶向免疫细胞/免疫节点相关单克隆抗体进展
2.1靶向免疫抑制分子
CTLA-4
2.1.1.1概况
分化细胞毒性T淋巴细胞相关抗原4(CTLA-4)是一种T细胞跨膜受体。CTLA-4与其配体B7分子的结合抑制T细胞的免疫活性并诱导免疫耐受的形成。
2.1.1.2代表毒品。
Ipilimumab,中文名Epimumab,商品名Yervoy。
2011年,FDA批准的靶向CTLA-4的全人单克隆抗体被批准用于治疗黑色素瘤,随后扩展到转移性肾癌、淋巴瘤、胰腺癌、前列腺癌、肺癌和膀胱癌。Ipilimumab的半衰期约为15天,常见的不良反应主要是T细胞过度活化和增殖引起的免疫不良反应,发生率约为10% ~ 20%。
根据施贵宝2016年年报,2016年该产品全球销售额为14.03亿元。
该产品尚未获准进口,但施贵宝的进口临床申请已获批准。
2.1.2程序化细胞死亡蛋白1(PD-1,CD279)
2.1.2.1概况
PD1属于免疫球蛋白超家族的细胞膜受体,主要在T细胞和B细胞中表达。PD-1受体有两个配体,PD-L1和PD-L2。PD-1激活T细胞,并与其配体结合抑制T细胞的活性。PD-1抑制性免疫信号是通过促进淋巴结抗原特异性T细胞凋亡,减少调节性T细胞凋亡来实现的。研究发现,以PD-1为靶点的抑制性免疫信号通路已成为治疗感染性疾病、肿瘤和自身免疫性疾病的潜在药物靶点。
2.1.2.2代表毒品。
pembrolizumab,商品名Keytruda。
莫东R&D是2014年FDA批准的首个抗PD1单克隆抗体,主要用于ipilimumab(抗CTLA-4抗体)无效的不可切除或转移性黑色素瘤患者。抗肿瘤只与T细胞PD-1结合,通过PD-L1阻断肿瘤细胞产生的信号,重新激活免疫系统对抗肿瘤。
根据默沙东2016年年报,2016年该产品全球销售额为12.43亿美元。
该产品尚未获准进口,但默沙东的进口临床申请已获批准。
(2)nivolumab,中文名Navumab,商品名Opdivo。
2014年12月,施贵宝针对PD-1的全人Navumab上市,用于治疗晚期鳞状非小细胞肺癌(NSCLC)患者。Nivolumab的主要不良反应包括肺、结肠、肝、肾和甲状腺的严重免疫性炎症反应。
根据施贵宝2016年年报,2016年该产品全球销售额为40.77亿美元。
该产品尚未获准进口,但施贵宝的进口临床申请已获批准。
没有国内企业的申报记录。
(3)atezolizumab,商品名Tecentriq。
2016年,基因泰克的PD-L1单克隆抗体atezolizumab(Tecentriq)被批准用于治疗膀胱癌和转移性非小细胞肺癌,目前正在进行结肠癌、黑色素瘤、乳腺癌和肾癌的临床试验。临床上应每三周静脉输注1200mg单克隆抗体。常见的不良反应包括恶心、尿路感染、疲劳和食欲不振。
没有该产品的销售记录。
该产品尚未获得临床批准,罗氏进口临床申请已获批准。
没有国内企业的申报记录。
2.2靶向免疫激活分子,如CD137/OX40
概述
肿瘤坏死因子受体超家族4(TNFRSF4,CD137,OX40)主要表达于炎症反应过程中活化的T细胞和树突状细胞、B细胞、滤泡树突状细胞、NK细胞、粒细胞和血管壁细胞。CD137在调节肿瘤免疫、T细胞的活化、增殖和粘附中起着关键作用。
2.2.2代表毒品。
utomilumab
2016年,辉瑞公司与美国国家癌症研究所(NCI)联合开发了全人IgG2单克隆抗体utomilumab。这种活化的单克隆抗体与CD137结合诱导T细胞免疫反应,与抗D-1单克隆抗体结合产生更强的抗肿瘤作用。
3. 其他
3.1抗IL-17A治疗炎性相关疾病
概述
细胞因子IL-17A主要由T细胞产生。与其受体IL-17RA和IL-17RF结合后,刺激成纤维细胞和胆管上皮细胞释放IL-1、IL-6、TNF-和CXCL1等促炎因子,最终导致类风湿性关节炎、银屑病和多发性硬化等慢性炎症疾病。
3.1.2代表药物
(1)secukinumab,suzumab,Cosentyx。
2015年,诺华公司的全人IgG1抗IL-17A抗体secukinumab (Cosentyx)上市,用于治疗中重度斑块型银屑病和强直性脊柱炎。
诺华2016年年报显示,2016年该产品全球销售额为11.92亿元。
该产品尚未批准进口,诺华的进口临床申请已获批准。没有国内企业的申报记录。
(2)伊西克单抗、伊珠单抗塔尔兹。
李来公司研发的人源化单克隆抗体于2016年获得FDA批准,成为第二个获批用于治疗成人中重度斑块型银屑病的IL-17A单克隆抗体。
(3)brodalumab (Siliq)
2017年2月,由FDA批准、Valeant公司研发的抗IL-17A受体单克隆抗体获准用于治疗中重度银屑病,成为首个在受体水平阻断IL-17A信号通路的单克隆抗体。三种针对IL-17A的抗体均可通过皮下注射达到满意的治疗效果。
3.2炭疽毒素保护性抗原(PA)
概述
罕见病吸入性炭疽是由吸入炭疽杆菌孢子引起的,主要通过空气释放传播。当人体接触到被感染的动物、被污染的动物产品或故意释放的炭疽孢子(生化攻击)时,就会发生感染。炭疽杆菌可在体内增殖并产生毒素,造成严重的不可逆组织损伤和死亡。2001年炭疽杆菌恐怖袭击造成5人死亡,不仅发现炭疽毒素对多种抗生素具有耐药性,还发现对抗或中和毒素可能是一种新的有效治疗方法。
3.2.2代表毒品。
(1)raxibacumab rexibakumab
美国人类基因组科学公司研发的抗PA人源化单克隆抗体,2012年获得FDA批准,用于治疗吸入性炭疽。Raxibacumab主要是皮下注射,不能用于静脉输注或皮内注射。
(2)奥比妥昔单抗
由Elusys Therapeutics开发并于2016年获得FDA批准的嵌合单克隆抗体,被用作治疗和预防吸入性炭疽的治疗和预防药物。在获得性免疫系统激活之前,静脉注射奥比妥昔单抗可提供约2 ~ 3周的PA中和作用。
3.3达比加群(diabigatran)
Diabigatran是新一代口服抗凝直接凝血酶抑制剂,于2010年被批准用于预防非瓣膜性房颤患者的中风和全身性栓塞。目前,该适应症已在全球多个国家获得批准。Diabigatran提供的抗凝作用稳定有效,药物相互作用少,无需常规凝血功能监测或剂量调整。2015年,勃林格殷格翰公司研发的单克隆抗体idarucizumab (Praxbind)获得批准,该药物具有拮抗diabigatran的作用。这种抗体可以在几分钟内逆转diabigatran的抗凝血作用,有效防止diabigatran使用者因意外出血而造成的致命伤害。
根据勃林格殷格翰2016年年报,2016年该产品全球销售额为2723万美元。
该产品尚未批准进口,进口勃林格殷格翰的临床应用仍在审查中。没有国内企业的申报记录。
3.4 PCSK9
概述
最近,发现PCSK9(前蛋白转化酶枯草杆菌in/kexin 9型)在维持脂蛋白体内平衡中起关键作用。PCSK9与肝细胞表面的低密度脂蛋白受体(LDLR)结合,并介导LDLR的降解。由于LDLR是LDL清除的主要受体,异常高的PCSK9不仅导致LDLR水平降低,还导致LDL-C水平升高。获得性和功能障碍性PCSK9突变分别导致高胆固醇血症和低胆固醇血症。
3.4.2代表药物
Alirocumab(Praluent)和evolocumab(Repatha)
赛诺菲公司的Alirocumab(Praluent)和安进公司的evolocumab(Repatha)于2015年被批准用于治疗动脉粥样硬化性心血管疾病或杂合子家族性高胆固醇血症。可以皮下施用抗PCSK9单克隆抗体来抑制PCSK9与LDLR的结合,从而增加LDLR的表达并降低LDL-C的水平.
赛诺菲和安进2016年年报显示,普鲁恩特和瑞普莎2016年全球销售额分别为1.59亿美元和1.65亿美元。
两者均未获得临床批准,无国产和进口申报记录。
4 总结
在过去的30年里,FDA批准了多种单克隆抗体药物用于疾病的治疗和诊断。单克隆抗体药物在自身免疫性疾病和肿瘤治疗领域取得了很大进展,也是医学领域发展最快、最有前景的发展方向。目前,用于治疗类风湿性关节炎的单克隆抗体的市场份额约为13%。单克隆抗体药物在血液病(如慢性淋巴细胞白血病、霍奇金淋巴瘤)、实体瘤(如鳞状细胞癌)、原发性肿瘤(如多形性胶质母细胞瘤)、肿瘤转移(如骨转移)的治疗中发挥着重要作用。同时,单克隆抗体药物也显示出治疗呼吸系统疾病(如过敏性哮喘)、中枢神经系统退行性疾病(如多发性硬化)、慢性胃肠道疾病(如克罗恩病)的前景。
近年来,中国生物医药领域取得了显著进展。作为仿制药大国,在生物仿制药领域也有一定发展。我国获批的生物药大部分属于仿制药。国内正在研究的100多种生物药,大部分属于改良仿制药。但由于我国至今没有针对生物仿制药的法律和指导原则,仍在现行的《药品注册管理办法》第12条中规定生物仿制药按照新药申请程序进行注册,浪费了大量不必要的资源,导致国内研发生产生物仿制药尤其是单克隆抗体药物的成本很高。对于中国来说,出台生物仿制药特别是单克隆抗体仿制药的指导原则是一个迫切的要求。CFDA开始了制定生物仿制药指南的前期工作。相关负责人表示,指南将进一步完善生物仿制药的技术要求和质量控制管理规定,以简化审批程序。生物仿制药的简化审批流程才刚刚开始,但面对即将到来的生物仿制药发展机遇,指南的制定将对我国生物仿制药产业的发展起到重要的推动作用。
单克隆抗体:开发生物类似物的关键
分析师认为,生物仿制药的市场将在未来几年迅速扩大。这种增长很大程度上是基于这样一个事实:随着许多“重磅炸弹”单克隆抗体(mAb)生物制品专利的到期,单克隆抗体生物类似物有望在未来几年内获准上市。比如英夫利昔单抗(Lyke,强生)、曲妥珠单抗(Herceptin,罗氏)、阿达木单抗(Sumelo,雅培)都会面临专利到期的问题。
2013年,欧洲药品管理局(EMA)批准了第一个单克隆抗体生物类似物,即由Celltrion公司和Hospira公司开发的Remsima/Inflectra。但在新兴市场,随着监管部门对生物类似物的审批方式越来越清晰,单克隆抗体生物类似物将获得更多的发展机会。同类药品生产企业对医生、药师、患者的教育,以及政府的大力支持,都需要进一步加强。同时,如果需要单克隆抗体生物类似物和生物类似物的市场。
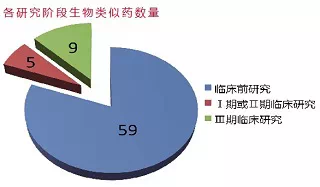
为一个整体,更应该充分发挥其潜力。麦肯锡公司估计,在开发的生物类似药中,40%是单克隆抗体。2012年3月的数据显示,正在开发单克隆抗体生物类似药为73只,其中59只处于临床前研究阶段,5只处于Ⅰ期或Ⅱ期临床研究,9只处于Ⅲ期临床研究。
至少有20家公司在开发曲妥珠单抗生物类似药。目前获得批准的生物类似药类别和数量都相对较小。单克隆抗体占据生物制品的较大比例。到2020年,数只年销售额超过50亿美元的单克隆抗体类药物将会专利到期,单克隆抗体生物类似药的开发将迎来带来极大的机遇。
利好与挑战并存
单克隆抗体生物类似药获批并不能保证其能够取得成功。制造商必须首先说服医生、药剂师和患者,还需要提供大量的临床数据以获得广泛认可。
单克隆抗体在新兴市场渗透率是有限的,主要是由于其成本高。因此,在这些国家中推出市场规模较大的单克隆抗体生物类似药将会获得巨大机遇。
在审批途径往往较为宽松或目前正在制定相关政策发展中国家,政府(如巴西和印度)以及跨国公司都在寻求推出单克隆抗体生物类似药。单克隆抗体生物类似药可以相对快速地在这些新兴市场推出,而企业也能获得市场经验以及可用于发达国家市场审批过程中所需要的数据。跨国公司更倾向于与本地制药或生物技术公司建立合作伙伴关系,以更方便地进入新兴市场。
欧盟已批准Celltrion公司和Hospira公司合作开发的英利昔单抗(Remsima/Inflectra)单克隆抗体生物类似药,这对未来单克隆抗体生物类似药的批准具有重要里程碑意义。
该批准的重要意义,不仅是因为在发达市场获得批准的第一个单克隆抗体生物类似药,而且还因为批准包括所有与品牌产品相同的自身免疫性疾病适应症,包括类风湿关节炎(RA)、强直性脊柱炎(AS)、克罗恩氏病(CD)、溃疡性结肠炎(UC)、银屑病关节炎(PSA)和银屑病。该生物类似药的开发,不仅显著节省成本和时间,更重要的是将最终对患者产生深远的影响。
另外,单克隆抗体生物类似药获得批准并不能保证其能够取得成功。生物类似药制造商必须首先说服医生、药剂师和患者,使用单克隆抗体生物类似药是安全和有效的,进行产品上市后的教育,这将需要提高企业的营销力度。此外,还需要政府的大力支持,鼓励单抗生物类似药能够被接受。当然,生物类似药制造商还需要提供大量的临床数据(如G-集落刺激因子)以获得广泛认可。
最后,大多数主要的跨国制药公司都在开发单克隆抗体生物类似药,包括辉瑞、安进、默克雪兰诺和勃林格殷格翰。领先的仿制药公司,包括山德士、麦兰和梯瓦,在该领域也是非常活跃。
因此,分析人士预计,未来的几年里,在发达国家和新兴市场将会有多只单克隆抗体生物类似药将被批准上市,如果这些产品能够被接受,将有助于生物类似药市场的显著快速成长。
复杂性决定开发难度
单克隆抗体生物类似药需要企业具有非常强大的创新能力,针对合适的研究终点和通过尽可能少的患者尽快设计适当的临床试验。同时,还需要现代化的生产设备和技术。
较小的蛋白质生物类似药已通过欧洲药品管理局(EMA)批准上市,如红细胞生成素、非格司亭、生长激素和促卵泡素α,而单克隆抗体更大、更复杂,难以充分证明其生物相似性。单克隆抗体的这种复杂性,需要更复杂的制造工艺,其中糖结构很重要,可以影响药物的药效。
单克隆抗体生物类似药需要企业具有非常强大的创新能力,包括最先进的分析来确定产品的初级和高级结构,选择合适的动物模型,仿真工具和复杂的设备,针对合适的研究终点和通过尽可能少的患者尽快设计适当的临床试验。同时,还需要现代化的生产设备和技术,才能够开发和生产出单克隆抗体生物类似药。
由于具有了这样广泛的要求,很多公司,特别是规模较小的公司,就不具备单克隆抗体生物类似药开发的能力,只能通过合作伙伴关系,集合各自的优势进行开发。
建立合作伙伴关系的公司包括:美国Hospira公司和韩国Celltrion公司、默克雪兰诺公司和印度雷迪博士实验室、三星和默沙东与Biogen公司、安进和阿特维斯或日本第一三共制药、百特和Coherus公司。
此外,较为复杂的生物类似药的开发成本相当昂贵,投入高达2亿美元,包括建设符合GMP规范的哺乳动物细胞培养设备,一支高学历、经验丰富的员工队伍等。
监管政策需要明确
新兴市场国家都在积极为生物类似药的批准发布相关政策,而且正迅速赶上。国家食品药品监督管理总局也开始对生物类似药审批程序进行征求意见。
单克隆抗体生物类似药开发的最大挑战,在于满足世界上不同国家/地区的需要,但在审批过程中缺乏透明度。欧洲无疑在这方面取得了领导者角色,自2006年以来建立了初具规模的生物类似药审批途径。在2012年,欧洲药品管理局 (EMA)还发布了最终的指导原则,《单克隆抗体生物类似药的非临床和临床要求》,包括药理毒理学、药代动力学信息、药效、疗效和安全性研究。
在2013年,该机构还发布了生物类似药与参比制剂比较的概念文件草案;类似的指导原则,临床和非临床的要求也进行了更新,并作出调整,以便当地申请者在新兴市场进行的临床试验可被采用。
美国的生物类似药政策就落后于欧洲。虽然美国自2010年3月开始采取相应措施,但缺乏美国FDA有关具体要求的指导原则,这对于生物类似药制造商来说,开发充满了不确定性。这种不确定性在2012年有所缓解,FDA发布了如何证明生物相似性以及可以用来评估生物相似性的数据的指导文件草案,同时还建议开发者在开发过程中与FDA合作。
在美国,对品牌产品生物类似药的更多指导原则也非常值得期待。在2013年,FDA推出了生物类似药用户收费方案。在该指导文件中,FDA强调该机构和生物类似药制造商之间的相互作用,并指出每种产品将根据具体情况逐案进行评估。
虽然这种方法使生物类似药生产商具有更多的灵活性,但它可能导致制药商在美国市场也可能缺乏安心投资于产品开发的信心。另外,制药公司还面临着对生物类似药替代品牌药可能的州级法规,如最近在美国加州就出台了相关政策。
在亚太地区,日本也发布了针对生物类似药的监管政策,而且几只产品已在日本获得批准上市。韩国也推出了类似的批准政策。2013年,澳大利亚治疗物品管理局也发布了生物类似药审批的指导原则。
很多新兴市场国家都在积极为生物类似药的批准发布相关政策,而且正在迅速赶上来。巴西、墨西哥、委内瑞拉、哥伦比亚和印度现在至少发布了生物类似药审批的草案。俄罗斯也正在制定审批途径,亚洲和非洲多个国家在采取相应措施。中国的国家食品药品监督管理总局也已开始对生物类似药审批程序进行征求意见。
不同国家生物类似药审批途径各不相同。在发达国家,审批途径往往是非常严格的。生物类似药开发者需要规划临床试验和开发流程,以满足每个不同国家各种严格的审评规定。有实力者开始仔细研究各相关国家的指导原则,根据各种要求制定单克隆抗体生物类似药发展战略的细节。
由于生物类似药(包括单克隆抗体)具有独特的性质,监管决定确实需要逐项地作出。每项评估必须是具体针对特定公司的创新产品和生物类似药产品,并考虑每项申请的特点,以及与其他申请的关联性。
总体判断生物相似性是至关重要的,对于生物类似药申请者,需要证明产品差异对质量、安全性或疗效有无临床意义的影响。
■编译/李勇
■来源/美国《国际生物制药》
■原文标题/Monoclonal Antibodies Key to Unlocking the Biosimilars Market