文|刘磊
21世纪是生物科学和生物技术的世纪。随着转基因技术、反义核酸技术、RNAi技术等基因操作方法的发展和完善,用分子生物学手段治疗遗传病、肿瘤、心血管疾病和代谢性疾病已成为本世纪的热点领域。自1990年FDA批准首个人类基因治疗临床试验方案以来,基因治疗的研究已经走过了近30年的历程,其研究发展迅速,取得了许多突破性进展。作为一项跨世纪工程,越来越受到科学界的关注。目前有少数临床试验疗效确切。
1、前 言
早在45年前,基因治疗的先驱西奥多弗里德曼(Theodore Friedmann)就提出,可以通过为患者提供正确的基因来治疗单基因遗传病[1]。原则上,基于蛋白质的治疗需要重复给药(例如糖尿病患者需要一直注射胰岛素),如果可以修复患者的错误基因或者直接提供正确的基因,那么单次治疗就可能产生持久的治疗效果。
基因治疗的发展漫长而曲折,早期临床研究中遇到的严重不良反应促使基因治疗研究转向更安全有效的基因转移载体。经过30年的探索,通过修改DNA来治疗疾病的基因疗法不再是未来的医学,而是今天临床治疗工具的一部分,这正在给医学领域带来许多新的治疗选择。
2、什么是基因治疗
基因治疗是将人类正常基因或治疗基因以一定的方式导入人类靶细胞,纠正基因缺陷或发挥治疗作用,从而达到治疗疾病目的的一种高科技生物医学技术。纠正的方法可以是原位修复缺陷基因,也可以是将功能正常的基因转移到细胞基因组的某一部分来替代缺陷基因。将外源基因导入生物细胞必须依靠一定的技术方法或载体。腺病毒载体是基因治疗中最常用的病毒载体之一。基因治疗主要是治疗那些对人类健康构成严重威胁的疾病,包括:遗传性疾病(如血友病、囊性纤维化、家族性高胆固醇血症等。)、恶性肿瘤、心血管疾病、传染病(如艾滋病、类风湿等。).
3、基因治疗发展史
基因治疗概念的形成有着非常悠久的历史,最早可以追溯到1963年,就在DNA双螺旋结构发表10年后,获得诺贝尔生理学或医学奖一年后,美国分子生物学家、诺贝尔生理学或医学奖获得者JoshuaLederberg提出了基因交换和基因优化的思想。70、80年代,限制性内切酶、DNA连接酶、逆转录酶相继被发现,基因重组工程技术得到发展,病毒载体出现,基因治疗的技术体系初步具备。1972年,美国著名生物学家西奥多弗里德曼(Theodore Friedmann)等人在《Science》杂志上发表了一篇被广泛认为具有划时代意义的前瞻性综述《基因治疗能否用于人类遗传病?》,提出基因疗法能否用于人类疾病的治疗。
随着基因的体外扩增,特别是PCR(聚合酶链式反应)技术的出现和完善,基因克隆技术日趋成熟,DNA重组技术和病毒载体进一步发展,分子生物学和细胞生物学开始进入黄金时代。到1990年,几个研究小组的一系列工作令人信服地证实了病毒介导的基因纠正和替换的可行性和有效性。
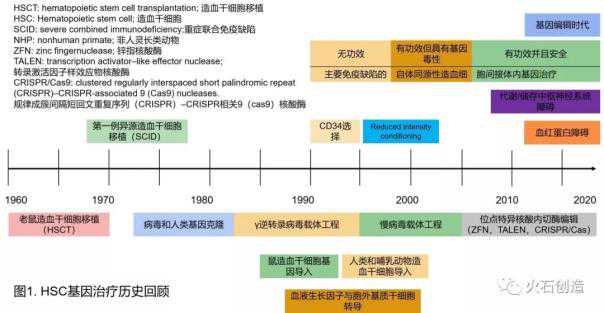
历史上第一个基因治疗的临床试验是由NIH的William French Anderson博士领导的严重联合免疫缺陷病(SCID)的基因治疗。安德森和他的合作者首先从4岁女孩阿散蒂德西瓦(Ashanti DeSilva)体内提取白细胞,然后在体外用逆转录病毒载体将能够正确编码腺苷脱氨酶的ada基因插入德席尔瓦的白细胞基因组,最后将这些基因工程改造的白细胞回输到德席尔瓦体内。这个案例无疑是基因治疗史上一个极其重要的里程碑。
但在基因治疗的临床试验早期,已经出现了一些因无效或意外毒性导致死亡的案例,导致了基因治疗的寒冬[2]。1996年,美国国立卫生研究院(NIH)顾问组得出结论,这些令人失望的临床结果是由对病毒载体、靶细胞和组织以及疾病的知识不足引起的。顾问团建议研究人员回归实验室,重视基因治疗的基础科学研究[3]。新载体的发展和对靶细胞的进一步了解导致了20世纪90年代末和21世纪初的第二代临床试验。这些实验证明,在某些情况下,靶组织的连续基因修饰可以获得临床益处。然而,由于高基因转移效率导致的严重毒性,基因治疗的进展再次放缓;例如:插入基因毒性、转基因细胞的免疫破坏、与某些载体相关的免疫反应[2,4,5]。
10年来,基因治疗的“科学”研究,安全性的提高,基因转移效率和输注的进一步成熟,终于推动了很多临床的进步。美国和世界各地的监管机构已经批准了一些基因和转基因细胞疗法作为药物,另有十几个获得了“突破性疗法”的称号。目前基因治疗的研究方向主要集中在基因递送载体、基因编辑和汽车治疗。
4、基因传递载体
基因治疗是一种生物医学技术,需要将目的基因转运到靶细胞,然后转运到细胞核。因此,基因治疗的关键技术是基因递送载体的设计。基因治疗通常使用病毒载体和非病毒载体。病毒载体主要包括慢病毒载体、逆转录病毒载体和腺病毒载体。非病毒载体主要是纳米载体和大分子载体。
腺病毒载体
腺病毒是目前临床基因治疗中应用最广泛的载体,占所有使用的基因治疗载体的24%。腺病毒载体在基因治疗中的优势在于:——可以方便地通过多种途径给药,如肌肉注射、静脉注射、口服和雾化吸入;安全性好。临床和实验研究证明,常用的腺病毒5型无致病和致癌作用,不会引起癌基因激活。寄主范围广。
但缺乏特异性靶向性,在一些缺乏相应受体的细胞中感染效率较低。目前很多实验室都在构建靶向腺病毒载体,主要针对腺病毒的天然吞噬作用,使其只能靶向特定受体[6]。体内应用过程中产生的免疫反应也限制了它的应用。空壳载体删除了病毒基因组,但仅保留了ITRs和包装信号。也叫裸腺病毒载体,是第三代腺病毒载体。在基因治疗中使用第三代腺病毒作为载体意义重大[7]。
逆转录病毒载体
逆转录病毒是一类已知的RNA病毒。逆转录病毒载体最大的优点是:转染谱广,可感染各种细胞类型;转移的外源基因可以完全整合;对细胞的感染率高,达到100%;被感染的细胞不引起病变,可以建立细胞系长期持续表达外源基因。据报道,以逆转录病毒为载体的血友病A基因治疗取得了很大进展[8]。
在20世纪80年代和90年代初,证明了开发的G-逆转录病毒载体可以将基因导入再生的造血干细胞。c-逆转录病毒可以将有效基因导入原始T淋巴细胞。第一代临床试验旨在使用这些载体将特定的缺陷基因转移到免疫缺陷或癌症患者的T细胞或造血干细胞的基因组中[9]。
造血干细胞基因治疗的历史如图1所示。其中,逆转录病毒载体(一般由小鼠白血病病毒MLV改造而来)是改造最早、应用最广泛的基因治疗载体。
慢病毒是逆转录病毒的成员之一,其特点是可以感染有丝分裂和静止细胞。此外,与其他载体相比,慢病毒载体的免疫原性相对较低。同样,它也可以将基因整合到宿主细胞中,使其长期稳定表达。因此,慢病毒在基因治疗中具有良好的应用前景。
其他病毒载体
除了上述常用的病毒载体,用于基因治疗的载体还包括腺相关病毒、单纯疱疹病毒、痘病毒和溶瘤病毒。其中,腺相关病毒最常用于眼部疾病的基因治疗,如遗传性视网膜变性。AAV载体作为基因转移载体,具有安全性好、宿主范围广、转染和表达效率高、目的基因可长期表达等优点。是视网膜色素变性基因治疗领域最具潜力和应用价值的病毒载体[6]。AAV载体来自一种非致病性、无包膜的细小病毒,该病毒天然具有复制缺陷。AAV载体的一个限制是它不能容纳超过5 kb的DNA(g-逆转录病毒或慢病毒载体可以容纳8 KB的DNA)。AAV矢量主要是不符合;转移的DNA作为自由基因是稳定的。这一特征降低了整合的风险,也限制了腺相关病毒载体在有丝分裂后在细胞中的长期表达。
非病毒载体
非病毒载体具有成本低、制备简单、便于大量生产、安全性高、外源基因长度不受限制等优点。最简单的非病毒基因转移系统是裸DNA,它可以直接注射到特定的组织,特别是肌肉中,导致基因的高水平表达。目前,正在研究的非病毒载体包括聚合物(聚L-赖氨酸、聚乙烯亚胺等。),复合载体和纳米颗粒载体。
与只能介导一种基因修饰(“基因添加”)的病毒载体不同,新的基因组编辑技术可以介导细胞中的基因添加、基因缺失、基因校正和其他高度靶向的基因组修饰。基因组编辑可以在体外或体内原位细胞上进行。靶向DNA取代是由核酸酶诱导的双链DNA断裂(DSB)启动的,这可以激活哺乳动物细胞中的有效重组。非同源末端连接(NHEJ)介导的修复可以有效地在DSB位点产生不同长度的插入片段或缺失突变(InDel),通常导致基因功能失活。同源定向修复(HDR),在同源供体DNA模板的存在下,产生特定的替代序列,重组后,纠正突变或在特定位点插入新序列。
早期的基因组编辑研究依赖于特定的锌指核酸酶(ZFN)[10]或超级核酸酶[11]在DNA靶位点诱导所需的DNA双链断裂(DSB)。这些核酸酶平台需要特殊的知识来定制特定的核酸酶结合效应蛋白以切割靶DNA,这限制了锌指核酸酶的广泛应用。2009年,证实了细菌蛋白质的DNA结合区,称为转录激活效应区(TALEs),很容易改变,这为TALEs的生产打开了创造之门[12,13]。这些酶可以有效地切割任何感兴趣的DNA序列。然而,TALEN的方法仍然需要为每个新的靶向DNA设计两种特定的核酸酶。
2012年,基因组编辑发生了巨大变化,Doudna和Charpentier取得了突破性的发现。细菌防御系统由具有规则间隔的短回文重复序列(CRISPR)-CRISPR相关核酸酶9(cas9)组成。CRISPR- Cas9核酸酶可以有效地、程序化地切割DNA位点,只需要设计一个与感兴趣的靶位点互补的特异性短链指导RNA(gRNA)即可。CRISPR-Cas9核酸酶技术迅速扩展到哺乳动物细胞,从而简化了基因组编辑过程。TALENs和CRISPR-Cas9核酸酶可以很容易地重新编程和切割特定的DNA序列,现在被广泛应用于无数的基础研究中[14-16]。
基因组编辑方法为校正或改变基因组提供了精确的手术刀,可以克服病毒载体介导的半随机基因组插入策略的诸多缺点。
5、CAR-T 疗法
工程T细胞正在成为一种强大的癌症工具(CAR-T细胞疗法如图3所示)。嵌合抗原受体(CARs)是合成的基因工程受体抗原,它将T淋巴细胞的特异性、功能和代谢整合在单个分子中[17,18]。抗原结合结构域CAR来自免疫球蛋白分子或T细胞受体,融合到细胞内信号转导结构域中,介导活化和共刺激以增强T细胞功能和持久性。与抗原的生理受体不同,CARs可以被设计成识别蛋白质、碳水化合物糖脂和HLA多肽复合物。CAR-T细胞疗法,全称嵌合抗原受体T细胞免疫疗法,是一种细胞治疗方法。它给T细胞增加了一个“嵌合抗原受体”,由GPS导航(胞外抗原识别区)和激活按钮(胞内信号转导区)组成。CTL019或CAR-T 019实际上是在肿瘤细胞表面增加了一个可以识别“CD19”的抗原受体。当“GPS导航”定位到肿瘤抗原并与之结合后,“激活按钮”开始激活T细胞,从而杀死肿瘤。说白了就是给自己的“军队”增加一个能准确识别“敌人”的“大杀器”。这些“变身”的特种兵回到人体后,可以很容易地找到带有特殊标志的“敌人”,并将其全部消灭。
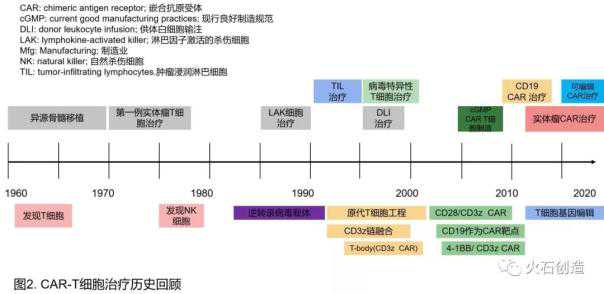
CD1CARS在临床上有益于难治性ALL和难治性弥漫大B细胞淋巴瘤(DLBCL)。2017年,FDA批准了两种基因工程细胞的产品,这是美国的首次批准。目前的研究目标是将CAR疗法扩展到髓系恶性肿瘤和实体肿瘤。这些疾病带来了挑战,因为可靠的肿瘤特异性细胞表面抗原尚未得到验证。此外,还需要一种方法来帮助CAR-T细胞进入更大的肿瘤或免疫特权区,克服肿瘤微环境信号。通用的第三方CAR-T细胞,可以使用“现成的”CAR-T细胞,与患者自己的特异性T细胞相比,将提供更快、更便宜的治疗。T细胞缺乏内源性T细胞受体和/或主要组织相容性复合物分子来降低GVHD和排斥的风险。临床前或早期临床研究是实现这一目标的第一步。CAR-T细胞已经对一些癌症的治疗产生了巨大的影响,这一成功为未来基于T细胞治疗其他癌症和其他疾病如自身免疫性疾病和艾滋病提供了基础。
6、结 论
基因治疗在经历了二三十年的失败、探索、再失败、再探索的螺旋式进步后,进入了快速发展阶段,其安全性和有效性得到了医药监管部门和医药巨头的认可。世界范围内,制药巨头葛兰素史克、诺华、辉瑞、赛诺菲等。已经通过收购或合作进入基因治疗领域,并投入基因治疗药物上市前最后阶段的推广。传统制药巨头的参与极大地推动了基因治疗的临床试验,基因治疗公司成为纳斯达克投资者的宠儿。然而,未来仍有许多挑战,包括解决整合基因载体的遗传毒性或关闭靶向基因组编辑,提高基因转移水平或基因组编辑效率,解决体内对载体的免疫反应,以及就基因组编辑的伦理争议和昂贵的治疗费用等问题达成社会共识。
基因治疗将是医学史上的一次革命,因为人本身,甚至其病变组织(如肿瘤)本身都成为“基因工程的制药厂”,长出来的药物(基因产物)将治疗人的疾病。但是,关键问题是什么时候实现。
虽然目前基因治疗仍有许多技术问题需要解决,但相信随着人类基因表达调控机制的阐明、转基因技术的发展和转基因方法的改进,基因治疗必将成为21世纪人类攻克疑难疾病的常规治疗手段。
参考文献(下拉展示)
[1].西奥多弗里德曼,理查德罗伯林。人类遗传病的基因治疗[J]。科学,1972,175(4025):949:955。
[2].基因治疗死亡——"每个人都有责任"。奈特尔。癌症研究所。92, 98100 (2000).doi:10.1093/jnci/92。2 .98;pmid: 10639505。
[3]s . h .奥尔金,A. G .莫图尔斯基,"评估(notinventedhere)排他性对基因治疗研究投资的小组的报告和建议,向(notinventedhere)排他性主任提交的报告"(1995)。
[4].尼恩胡斯,邓巴,索伦蒂诺,造血细胞中逆转录病毒整合的遗传毒性。摩尔另一个.13,10311049 (2006).doi:10.1016/;pmid: 16624621
[5].临床试验中对两栖突击车的免疫反应100 . 00元人民币.基因疗法。11, 321330 (2011).doi:10.2174/156652311796150354;pmid: 21557723
[6].腺病毒载体在基因治疗研究中的应用[J]的缩写.李爱玲。陕西农业科学.2012:58(5),103~104
[7].腺病毒载体及其在基因治疗中的应用[J]的缩写.王素华。中国畜牧兽医.2009:36(9),119~121
[8].基因治疗研究进展[J]的缩写.罗丹云。四川生理科学杂志.2009:31(4),176~178
[9].造血干细胞的基因转移:对人类疾病基因治疗的启示。安奴。47, 1120 (1996).doi:10.1146/;pmid: 8712765
[10].乌尔诺夫,力霸,霍尔姆斯,张,格雷戈里,基因工程锌指核酸酶的基因组编辑。纳特。吉内特牧师。11, 636646 (2010).doi:10.1038/nrg 2842;pmid: 20717154
[11]g .席尔瓦等,靶向基因组工程的大核酸酶和其他工具:基因治疗的前景和挑战100 . 00元人民币.基因疗法。11, 1127 (2011).doi:10.2174/156652311794520111;pmid: 21182466
[12]克里斯蒂安先生等,用t al效应物核酸酶靶向脱氧核糖核酸双链断裂。遗传学186,757761(2010年)。doi:10.1534/;pmid: 20660643
[13].T .李等,t al核酸酶(塔尔恩斯):由湖效应子和福基DNA切割酸组成的杂合蛋白,研究39,359372(2011)。doi:10.1093/NAR/gkq 704;pmid: 20699274
[14]j . k . Joung,J. D. Sander,TALENs:一种广泛适用于靶向基因组编辑的技术。纳特。生物修订版。14, 4955 (2013).doi:10.1038/NRM 3486;pmid: 23169466
[15].基因组编辑、调控和靶向系统。纳特。生物技术。32,347355 (2014).doi:10.1038/;pmid: 24584096
[16]科莫尔,巴德兰,刘,基于CRISPR的真核生物操纵技术168,2036(2017)。doi:10.1016/;pmid: 27866654
[17]m .萨德兰、I .里维尔、r .布伦特斯、用基因增强的T淋巴细胞靶向肿瘤。纳特。癌症评论3,3545(2003年)。doi:10.1038/NRC 971;pmid: 12509765
[18]m .萨德兰、r .布伦特斯、I .里维尔、嵌合抗原受体设计的基本原则。癌症发现。3, 388398(2013).doi: 10.1158/2159-8290 .CD-12-0548;pmid: 23550147