阿尔茨海默病,AD),俗话说“阿尔茨海默病”,在奥斯卡提名短片《勿忘我》中以动画的形式展现了阿尔茨海默病患者的世界。动画中,老人逐渐失忆,甚至忘记了最爱的人。他的脑海里是一个褪色的世界,残酷而绝望。
遗憾的是,阿尔茨海默病的发病机制复杂,具体机制至今未完全破译。目前主流观点认为,细胞外-淀粉样蛋白(A)在脑内逐渐沉积,细胞内Tau蛋白积聚,导致神经元死亡和认知障碍。
A蛋白沉积
a蛋白是淀粉样神经炎斑块的主要成分,由淀粉样前体蛋白(APP)代谢产生。从APP到A蛋白的转化过程如下
它是APP跨膜糖蛋白。APP被膜附近的-分泌酶的胞外蛋白酶切割,通过切割释放可溶性胞外片段SAPP 。同时也被-分泌酶1的天冬氨酰蛋白酶(BACE1)切割,释放出可溶性胞外片段APP和膜结合片段(C99)。然后,C99被膜中的-分泌酶复合物切割,释放出A蛋白和细胞内肽(AICD)。
蛋白在神经元活动增强的环境下分泌释放到间质液中,并聚集形成寡聚体、原纤维,最终形成斑块(图2)。2021年6月7日,FDA批准Aducanumab作为早期阿尔茨海默病的治疗药物。adukanuzumab作为近20年来首个获批的治疗阿尔茨海默病的药物,其主要作用机制是:作为一种针对A构象的高亲和力单克隆抗体,与阿尔茨海默病(AD)患者脑内的淀粉样蛋白结合,最终达到清除的目的。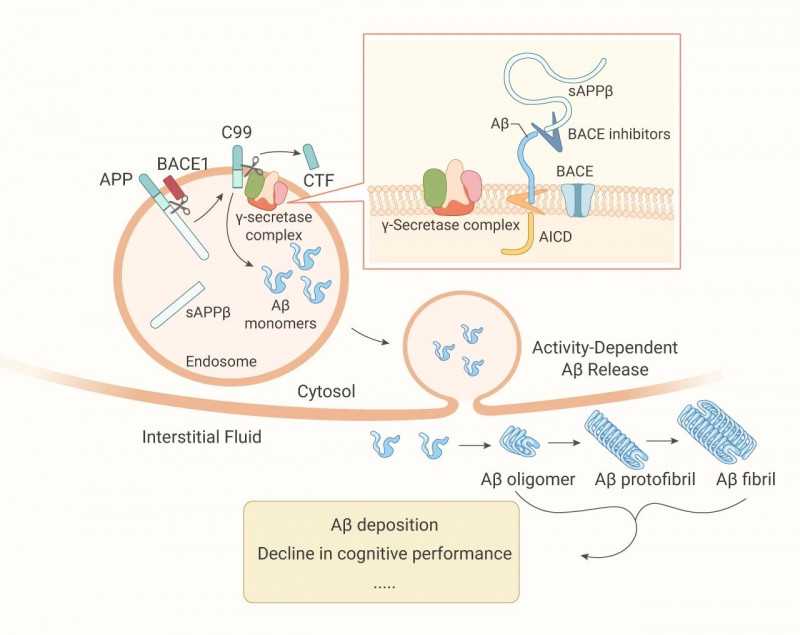
图一。A蛋白沉积[1][2]
Tau蛋白聚集驱动AD产生Tau蛋白,与认知障碍的进展密切相关。研究表明,随着年龄的增长,即使没有认知能力下降,Tau病理也会在内嗅皮层和内侧颞叶累积,即所谓的原发性年龄相关Tau病变(部分)。已经证明Tau蛋白在微管的组装、神经元轴突的稳定和微管运输的调节中起重要作用。虽然Tau基因敲除(KO)小鼠没有表现出严重的发育表型,但它们在细胞培养中表现出明显的神经元成熟延迟和突触可塑性受损。
正常情况下,Tau蛋白通常以其天然单体形式存在,但在阿尔茨海默病患者的大脑中,Tau蛋白聚集物沿着神经解剖连接线以固定的方式出现。错误折叠的Tau蛋白促进错误折叠的天然Tau单体,这进一步导致新的病理性Tau蛋白聚集体的产生。
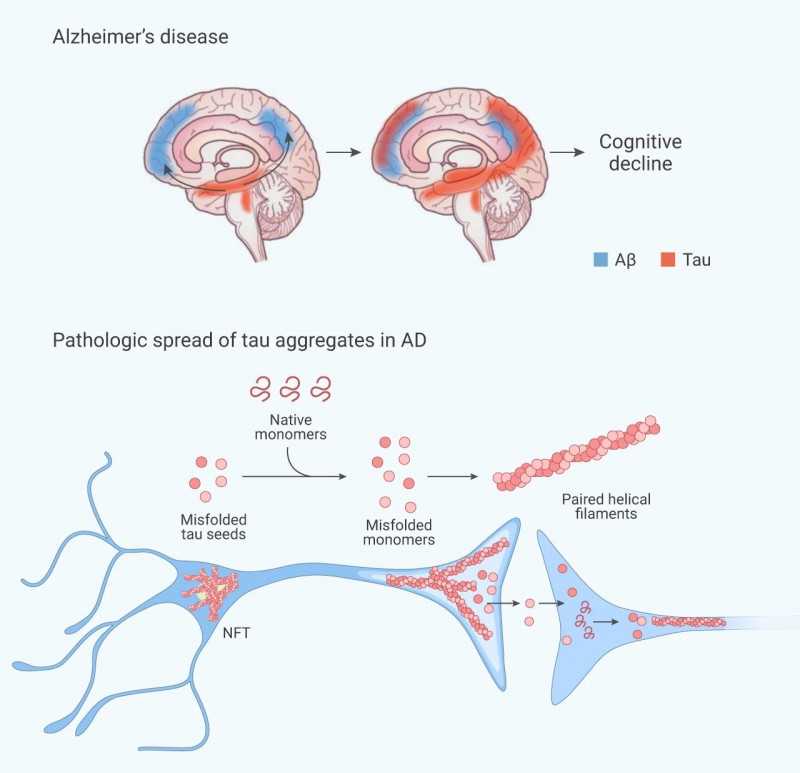
图二。Tau蛋白聚集[2][3]
Tau蛋白还受到许多翻译后修饰的影响,包括磷酸化、乙酰化、糖化、O-GLC酰基化等。Tau在不同位点的磷酸化反应了疾病的进展。在AD早期,神经原纤维缠结(NFT)尚未形成,Tau的磷酸化位点主要出现在Ser199和Ser422。随着疾病的进展,Ser202和Thr205的磷酸化程度会不断增加。Thr231位点的磷酸化一般说明更成熟的p-Tau组装形成NFTs,将疾病推向晚期。乙酰化修饰也起着重要的作用。最近,发表在《细胞》杂志上的文章《减少乙酰化tau在脑损伤中的神经保护作用》表明,创伤性脑损伤(TBI)是AD中的一种非遗传性和非衰老相关的危险因素,它在具有TBI病史的AD患者大脑中的乙酰化位点诱导tau乙酰化(ac-tau)。阿尔茨海默病发病机制复杂,那么用什么动物模型来研究阿尔茨海默病呢?
显示A损伤的小鼠模型
注射蛋白:许多研究人员选择将有毒的A多肽直接注射到小鼠和大鼠的大脑中,模拟阿尔茨海默病(图4)。这种注射方法可以模拟分子水平和行为水平的变化,比如学习记忆障碍。这种建模方法建模时间短,但个体差异大,注射法考验技巧。
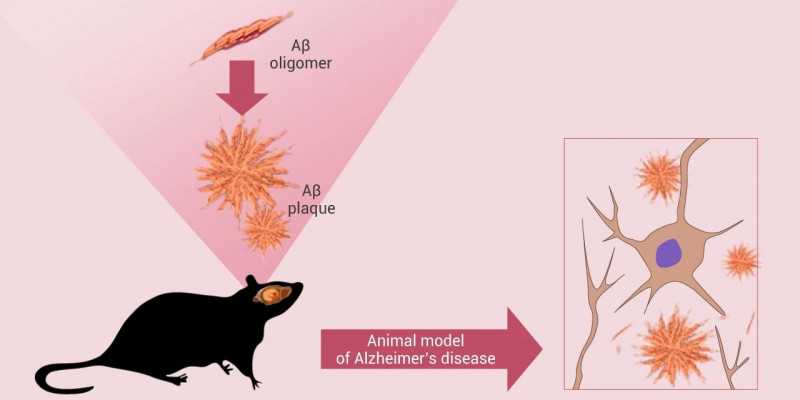
图3。A蛋白注射诱发疾病模型[5]
除了上述方法,还有基于人APP或PS1突变基因的小鼠模型。野生小鼠和人类的APP蛋白存在氨基酸位点的差异,一般不能自发产生A沉积。因此,A相关的病理变化只能通过转移人APP基因来显示。例如,PDAPP小鼠在PDGF-启动子的调控下表达人APP Indiana突变(APPV717F),使APP表达上调(小鼠内源性APP的10倍)。模型小鼠在6~9个月龄时开始出现A斑块,表现为年龄依赖性淀粉样蛋白沉积和脑内硫黄素-S阳性斑块,包括核心致密的致密斑块,与人类AD中所见相似。
显示Tau损伤的转基因小鼠模型
JNPL3小鼠是首个通过P301L突变构建的Tau转基因小鼠模型,能够在小脑、海马和脊髓过度表达人TauP301L蛋白,并使神经原纤维缠结呈年龄和基因剂量依赖性发展。除了P301L突变,P301S也是一种常见的Tau转基因小鼠模型。例如,在6月21日发表在《神经元》杂志上的过度表达低密度脂蛋白受体减少tau相关的神经元变性与apoe相关的机制中,我们的团队证明了LDLR牛减少了apoE的表达,并减少了P301S小鼠的Tau病理和神经变性。
作者将LDLR转基因小鼠与P301S小鼠杂交,产生P301S/LDLR杂交小鼠。结果显示,在P301S小鼠中,P301S小鼠的海马和梨状/嗅皮层出现严重的脑萎缩(图5A),突触染色结果显示P301S小鼠海马CA3区透明层的突触明显缺失(图5B)。与P301小鼠相比,P301S/LDLR小鼠的所有上述症状均得到缓解,并且p-tau染色被LDLROX改变为早期模式(图5C,5D)。
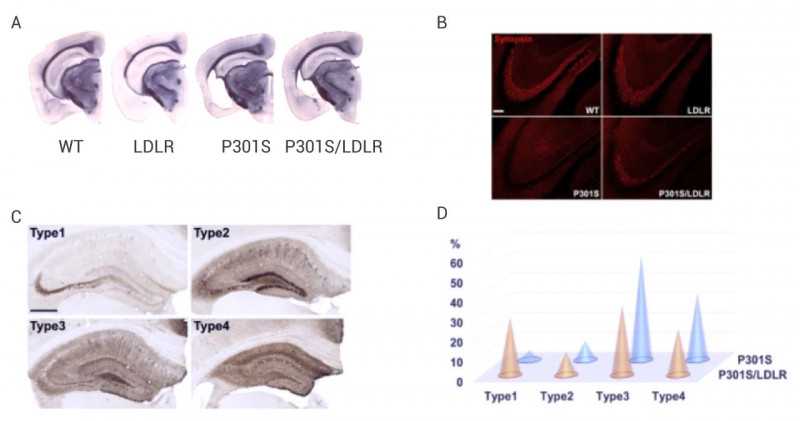
图4。P301s小鼠中的LDLR牛减少了神经变性[6]
答:苏丹黑染色;b:突触素染色;AT8染色的四种不同的p-tau模式;P301s和P301S/LDLR小鼠的D. p-tau染色模式分布
同时表达A和Tau损伤的转基因小鼠模型
除了上述转基因模型,目前公认的能够完全模拟AD病理变化的模型是3xTg小鼠,其携带3个f AD突变:APPK670N/M671L、TauP301L和PS1M146L。例如,最近发表在《细胞》杂志上的题为“伴侣介导的自噬预防神经元亚稳态蛋白质组的崩溃”的文章证明,CMA激活可以改善AD样病变。
研究小组使用了AD (Tg)三种转基因小鼠模型,并从第八个月的小鼠开始给予CMA激动剂(简称CA)(图6A)。Tg小鼠表现出类似焦虑和抑郁的行为,记忆力明显下降。荧光结果显示,3xTg小鼠背海马早期p-T231tau蛋白水平、未成熟淀粉样斑块(MOAB2)、成熟淀粉样沉积物(6E10)、折叠蛋白和pThr231tau显著上调(图6B)。结果还显示,背侧海马小胶质细胞(Iba染色)和星形胶质细胞数量明显增多,胶质细胞和淀粉样斑块沉积共定位染色明显(图6C)。但CA管理组能明显改善上述情况。总之,这些结果证明CA对AD相关的病理具有有益的作用。
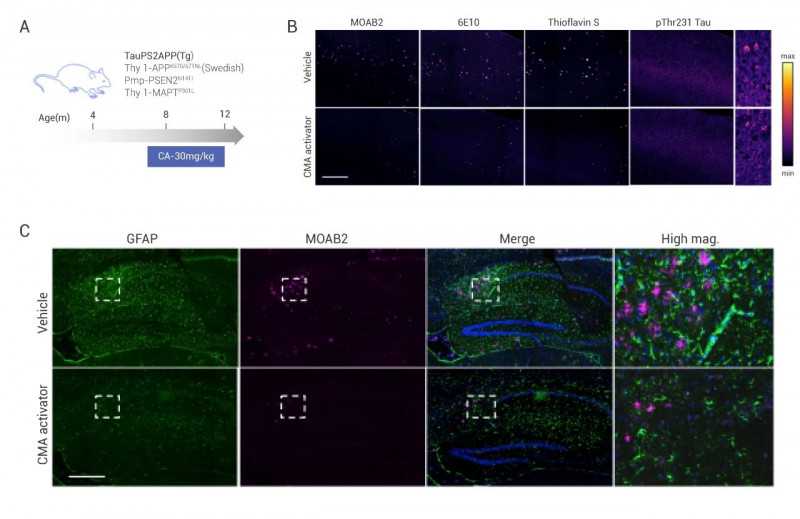
图5.3小鼠背海马染色[7]
3xtg车型示意图;b:AD疾病相关指标染色;c:胶质细胞染色
总结:在这篇文章中,小M介绍了目前关于老年痴呆症发病机制的主流观点。A是斑块或非纤溶的、低聚的形式,最终形成致密的蛋白斑块(“老年斑”);Tau蛋白折叠组装错误,不断扩散,最终导致神经并扩散到整个皮层,导致神经系统衰竭,神经退行性变,认知能力下降。