
杜德娜
CRISPR-Cas系统作为基因组编辑和调控的编程工具,可用于各种细胞(包括人类细胞)中的遗传操作。目前,科学家的注意力主要集中在CRISPR-Cas系统在治疗孟德尔遗传疾病方面的潜力,但该技术有望为复杂的体细胞疾病提供新的治疗方法。同时,CRISPR-Cas将通过加速药物靶标的识别和验证,成为下一代药物研发的有利工具。
近日,CRISPR ——“女神”的开创者詹妮弗在《自然》杂志上又有新的建树。她的研究团队发现了两个新的CRISPR系统,非常令人兴奋。可以看出,CRISPR从诞生之日起就一直给人们带来惊喜,可以说引发了遗传学、医学等生物学研究的一场革命。詹妮弗也参与了12月23日在线发表的文章《Nature Reviews Drug Discovery》。这一次,他们把目光投向了CRISPR-Cas系统带来的药物发现途径和疾病治疗方案的创新。
CRISPR-Cas系统是指成簇的规则间隔的短回文重复序列(CRISPR)和CRISPR相关蛋白(Cas),可以快速准确地改变哺乳动物模型系统和人体组织中的基因组信息。通过直接编辑患者的体细胞,引入纠正性突变或修改调控元件,几乎所有靶点的药物开发都是可能的。
CRISPR-Cas系统可以概括为:sgRNA引导Cas9内切酶在同源位点诱导双链断裂,然后通过细胞DNA修复机制进行修复,包括NHEJ和HDR。NHEJ最常用于破坏基因序列,而HDR可用于通过设计的修复模板在特定位点引入或改变遗传信息。失活的突变体Cas9可以与各种效应子结构域融合,激活或抑制靶基因的转录,分别称为CRISPRa和CRISPRi策略。
CRISPR-Cas作为药物发现的工具
1 建立精确的细胞模型(应用于药物靶点发现)
DNA测序的发展及其大规模应用刺激了“个性化”或“精确”医学的发展。虽然基因(如TP53、MYC或KRAS)的突变状态可以在细胞间进行比较,但通常还有许多其他混淆特征掩盖了基因型和疾病类型之间的直接关系。研究人员可以使用患者和正常人的组织样本进行比较,或者通过过量表达适当cDNA的技术,但这些原始技术会消耗大量的劳动力和时间,这阻碍了它们在药物开发中的广泛应用。
CRISPR-Cas基因编辑的出现极大地改变了这种情况。CRISPR-Cas基因敲除已被证明用于几乎所有细胞类型,包括诱导多能干细胞(ipsCs)和癌症特异性免疫细胞。这种基因敲除可以让研究人员快速确定癌基因、肿瘤抑制因子等因素在一定背景下的致病作用。同样,通过HDR“敲入”突变等位基因,研究人员可以测试疾病相关等位基因突变的影响,例如与各种癌症相关的KRAS等位基因的研究,并可以分析突变体对疾病发展的影响或验证突变体靶向治疗候选物的特异性。
HDR需要以病毒载体、质粒(编码Cas9和sgRNA)或Cas9-sgRNA核糖核蛋白(RNP)复合物的形式递送Cas9-sgRNA复合物和DNA修复模板。虽然CRISPR-Cas敲除在几乎任何细胞中都有效,但效率因细胞类型而异。在无传染性的人类细胞(包括神经元)中很难实现适度的HDR。这些障碍令人沮丧,因此科学家们绕过HDR途径,使用非同源或微生物介导的方法来实现在非有丝分裂人类细胞中的应用。另一个令人振奋的发展是应用了具有附加功能的Cas酶,它可以直接改变靶碱基,实现不需要模板的精确和特异性突变的引入。实现这一目标的一个重要方法是融合各种胞苷脱氨酶和Cas9。
2 快速生成动物模型(推动新药动物实验发展)
除了细胞培养应用之外,基因编辑极大地改变了产生疾病动物模型的能力。CRISPR-Cas工具最初开发后不久,就被用于生产多种基因突变的小鼠。CRISPR-Cas可以一步靶向多个基因,快速产生双突变和多突变小鼠,但必须注意的是,这些等位基因并不依赖于育种后的孟德尔分离。通常,有效的CRISPR-Cas编辑技术(包括NHEJ和HDR)可以通过受精卵中的显微注射或简单的电穿孔来实现,而不需要使用传统的胚胎干细胞操作。受精卵中的基因编辑省去了分离、培养和编辑es细胞的步骤,节省了时间,加速了在现有动物模型中产生额外突变的过程。然而,通过受精卵编辑引入大量转基因或复杂的多组分系统仍然是低效的,因此es细胞中的基因打靶仍然是产生具有这种突变的动物的首选方法。
总的来说,CRISPR-Cas通过减少生成目标模型所需的时间来不断创新小鼠遗传学。目前,CRISPR-Cas可以通过使用病毒或基于转座子的载体,在一些组织中直接引入体细胞突变,如肺和肝组织。这种方法被用来建立癌症和其他疾病的模型。
针对CRISPR-Cas有很大的前景。在除小鼠以外的临床前模型中,传统的基因打靶仍然很困难,而CRISPR-Cas编辑已经在大鼠、狗和猴子中进行,这是临床前药物发现和开发过程中常用的方法。灵长类动物疾病模型的产生,如恒河猴的杜氏肌营养不良,进一步强调了基因编辑可用于测试治疗化合物的疗效和安全性。
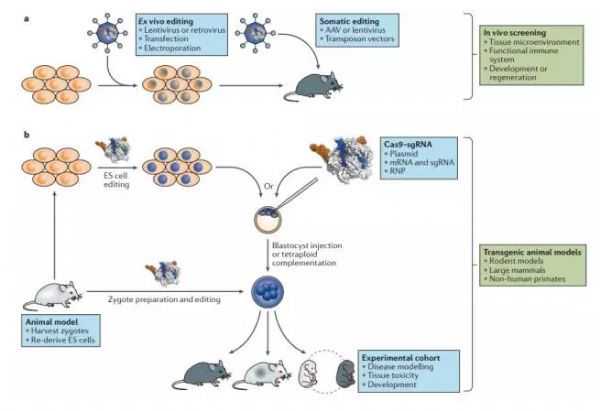
CRISPR建立动物模型过程
CRISPR-Cas提供新的治疗方案
1 应用于CAR-T细胞治疗
随着癌症免疫治疗的快速扩展,基因编辑在躯体疾病中的应用集中在下一代嵌合抗原受体(CAR)T细胞的产生上。
CAR含有细胞外结合域(目前为单链可变区),能识别肿瘤细胞上强表达的、特异性的抗原,激活T细胞的细胞内信号转导,促进T细胞介导的肿瘤细胞杀伤。第一个CAR-T细胞介导的治疗以CD19为目标,CD19是一种由B细胞和相关癌细胞表达的抗原。这些疗法中的几种已经进入临床试验(Juno Therapeutics:NCT02535364和NCT02631044;风筝制药:NCT02601313和NCT02348216;诺华:NCT02030834和NCT02445248)。目前,大多数CAR-T细胞是使用每个患者自己的T细胞产生的,涉及每个新患者T细胞的分离、修饰和扩增。所以CAR-T细胞的经济性比基于抗体检查点的癌症免疫治疗(如ipilimumab、pembrolizumab、nivolumab)差。如果能生产出通用的供体CAR-T细胞,CAR-T细胞疗法就能变得更快更便宜。然而,CAR-T细胞识别由受体细胞引起的移植物宿主排斥仍然是现有方法的主要障碍。
CRISPR-Cas可用于敲除内源性T细胞受体基因,以防止宿主反应性,也可用于消除或减少供体T细胞上组织相容性抗原的表达,以防止或延迟受试者免疫系统对CAR-T细胞的排斥。此外,基因编辑还可以通过敲除编码T细胞抑制性受体或信号分子的基因,如细胞毒性T淋巴细胞相关蛋白4(CTLA4)或程序性细胞死亡蛋白1(PD-1),来促进CAR-T细胞的功效。
美国国立卫生研究院(NIH)重组DNA咨询委员会(RAC)最近批准了在宾夕法尼亚大学进行的黑色素瘤靶向CAR-T临床试验,其中Cas9将用于敲除编码PD1和内源性T细胞受体的基因。中国最近开始了CRISPR-Cas的首次临床试验。这项实验使用Cas9敲除肺癌个体T细胞中的PD-1。类似的实验,针对前列腺癌、膀胱癌和肾细胞癌的PD-1敲除T细胞也正在开始。
2 离体基因编辑治疗
将药物输送到细胞或组织是非常具有挑战性的,这是药物治疗的主要限制。应用体外操作靶细胞的CRISPR-Cas可以避免这个问题。造血系统是体外基因编辑的绝佳目标,因为细胞很容易从外周血样本中获得,经过操作和扩增后可以重新注射。例如,研究人员使用ZFNs破坏从艾滋病毒患者体内分离出的T细胞中的CCR5基因,然后将其扩增,再将编辑过的T细胞重新注入患者体内,以生成抗艾滋病毒的自体T细胞。这种方法的I/II期临床试验正在进行中。虽然T细胞中CCR5基因的突变是永久性的,但T细胞本身不是。最近,研究人员正在努力破坏HSC中的CCR5,以产生长期自我更新的抗艾滋病毒细胞。
总之,CRISPR-Cas编辑可以加快功能基因组学的发展,揭示细胞机制和确认新药靶点,开发更好的安全测试模型,改进治疗方案。快速基因编辑还可以生成定制的自体细胞疗法,包括用于癌症治疗的T细胞和重新编程的ipsC,可应用于非遗传性疾病的创新疗法。虽然CRISPR-Cas系统还将进一步完善,但我们认为基因编辑已经开始对全世界的药物发现和开发产生直接影响。
原文来源:
CRISPR的基石——药物发现和治疗中的Cas