5月15日,美国食品和药物管理局(FDA)批准辉瑞公司Hospira公司旗下的药物瑞他克里特(epoetin alfa-epbx)作为Epogen/Procrit(epoetin alfa)的生物仿制药,用于治疗慢性肾病、化疗或使用齐多夫定治疗艾滋病毒感染引起的贫血,并减少手术前后的失血量。
这是辉瑞第三次向FDA申请该生物仿制药上市,最终获得批准。2015年,辉瑞首次申请,FDA要求辉瑞提供更多数据。2017年,辉瑞再次申请,但由于该药物的制造商收到了FDA的警告信,因此再次搁置。有了这个批文,辉瑞终于可以瓜分原来药企安进和强生的市场利益了。据悉,2017年Epogen/Procrit在美国市场的销售额约为18亿美元。
与此同时,辉瑞公司研发的罗氏赫赛汀生物仿制药尚未上市,罗氏公司因为认为其药物专利被侵犯而提起诉讼。如果辉瑞在赫赛汀相关专利到期前上市,必须向罗氏旗下的基因泰克支付赔偿费用。
为什么辉瑞不全力研发并申请很多生物仿制药上市?因为生物制药市场的利润太丰厚了。

原研生物药的红利
Igeahub在4月发布了《2018年全球最畅销药物TOP20榜单》。预计2018年处方药市场规模约为8110亿美元,2022年将达到10500亿美元。2017年,全球最畅销的10大药品总销售额达到867.7亿美元,约占全球处方药市场的10.7%。2018年全球10大畅销药品中,生物药占据7个名额:
Humira(阿达木单抗)是艾伯维的超级重量级产品,2017年全球销售额184亿美元,较2016年增长14.6%,在《2017年全球处方药销售榜》中排名第一。这种药的适应症主要是治疗自身免疫性疾病和中重度活动期类风湿性关节炎。在美国,Humira核心专利已于2016年到期,在欧洲将于2018年到期。
Eylea (Apxip)由拜耳与Regeneron合作研发,2017年全球销售额为82.3亿美元,较2016年增长62.97%。在美国,Eylea已被FDA批准用于多种视网膜疾病,是该市场抗VEGF治疗领域的主流产品。
Rituxan(利妥昔单抗)是罗氏与百健合作研发的。2017年全球销售额为81.1亿美元,比上年下降5.47%。该药的适应症为各种白血病、淋巴瘤、移植排斥和自身免疫性疾病。2015年核心专利到期,导致销量下滑。
恩利(Etanercep)由安进公司研发,2017年全球销售额为79.8亿美元,比上年下降10.03%。该药的适应症为自身免疫性疾病,包括类风湿性关节炎、银屑病等炎症性疾病。
赫赛汀(曲妥珠单抗)是罗氏的重量级产品。2017年,其全球销售额达75.5亿美元,比上年增长15.98%。这种药物的销售增长主要是由中国市场的额外报销批准和美国市场与Perjeta联合使用时间的延长(适应症为乳腺癌)推动的。
阿瓦斯丁(贝伐单抗)是罗氏的又一重磅产品,2017年全球销售额72.1亿美元,比上年增长10.75%。由于肺癌适应症的批准,这种药物在全球市场的销售持续加强,尤其是在中国。该药物主要用于治疗晚期结直肠癌、乳腺癌、肺癌、肾癌、宫颈癌、卵巢癌和复发性胶质母细胞瘤。
Remicade(英夫利昔单抗)由强生公司和默沙东公司联合生产。2017年全球销售额为71.6亿美元,比上年下降8.55%。欧洲主要市场和其他地区的专利在2015年2月后到期,这种药物的销量一直在下降。
根据evaluate的统计,到2020年,有专利保护期的生物制药市场规模将接近874亿美元。这意味着生物仿制药的市场将达到近1000亿美元,但根据Kalorama Information最新发布的报告《生物仿制药:全球市场、趋势和竞争对手分析》,到今年年底,生物仿制药的全球市值将增至近62亿美元。他们之间有相当大的差距。为什么?
生物仿制药的阻碍
医疗市场研究人员指出,生物制剂的研发过程相当复杂。虽然生物仿制药被称为仿制药,但生物药和化学药的仿制药研发有很大不同。
小分子化学药物通常是化学合成的,大分子生物药物是生物合成的。生物药物的分子大小可能比化学药物大几百倍到几千倍,更重要的是生物药物的分子结构远比化学药物复杂。而且生物药物的结构生物合成后,通常会有一个翻译后修饰的过程,这些变化可能对药物的生物活性至关重要。这些特点注定了生物仿制药不可能和原研生物药完全一样。即使是同一家公司生产的同样的原研生物药,批次之间也会有差异。因此,biosimilar的英文名是biosimilar,也称为biosimilar。
除了复杂的R&D过程、不完善的监管法律法规、原研药专利的不断延长,生物仿制药市场无法激活。
欧盟是世界上第一个制定生物仿制药政策和法律框架的国家。2003年发布生物仿制药申请通道,2006年第一个生物仿制药获批。然而,在世界上最大的药品市场美国,生物仿制药的审批和监管过程缓慢。
2009年,美国《生物药价格竞争及创新法》 (BPCI法案)建立了一个列入生物类似物的简化程序。2010年3月,奥巴马的医改法案制定了生物仿制药进入市场的简化申请方式,称为“生物仿制药途径”。2012年2月,美国FDA终于发布了三份生物仿制药研发指南草案,为生物仿制药上市建立了快速审批通道。
美国的监管部门执着于仿制生物药的复杂性和难度,生物药能否完全复制原药的效果,以及之前法案中生物药概念的冲突和审批程序的纵横交错。同时,原研药企也会利用各种法律手段,尽可能拖延仿制药上市时间。迄今为止,FDA仅批准了10种生物仿制药,包括最新的Retacrit(epoetin alfa-epbx)。
九种生物相似药物获准在美国上市
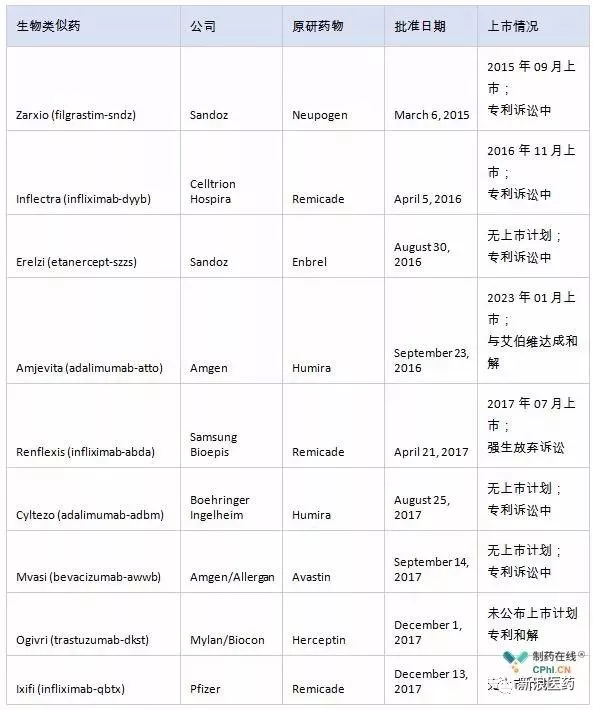
从专利诉讼中可以看出,大多数获准上市的药物都是专利,生物制药复杂的专利权是限制生物仿制药进入市场的另一个障碍。专利一直是知识产权世界的一部分,包括专利权、商业秘密和专有技术。知识产权在生物制剂的研究、开发和商业化中非常重要。生物专利法及其复杂性使得生物仿制药公司面临诸多问题,包括产品专利重叠、专利独占期、孤儿药认定等。而且,原创药企还在为自己想要保护的药物申请越来越多的“非创新”专利,迫使仿制药企业进入专利诉讼的“迷宫”。
生物仿制药委员会执行主任克里斯汀西蒙斯(Christine Simmons)表示,截至今年4月1日,FDA有63个项目或生物仿制药审查申请,涉及31个品牌的生物制剂(也作为参考制剂)。如果获得批准,这些生物仿制药将以较低的成本改善重病患者昂贵的治疗费用。美国只有不到2%的人使用药物,但药物支出却占了26%以上。
但西蒙斯也指出,一旦有竞争力的生物仿制药进入市场,一些原始制药公司威胁要取消向付款人提供的折扣。或者传播误导性信息,就是医生和患者都在担心生物仿制药的安全性和有效性,尽管生物仿制药必须通过与新药类似的严格的FDA检测和审查程序。他们必须确保生物仿制药被有效地排除在市场之外。这些都会阻碍公司为生物仿制药的发展提供肥沃的土壤。
Kalorama Information报道称,许多公司正在争夺生物仿制药市场的地位。一些企业将在欧洲、日本和北美以外的市场竞争,或者与世界上的其他公司合作。中国生产生物仿制药多年,非常适合与西方企业建立合作关系,包括辉瑞、无名生物、信达生物、三生制药等。已全部投入生产线。印度也在生物仿制药领域发展。然而,欧盟仍然是生物仿制药发展的领导者,这为欧盟生物仿制药行业带来了竞争优势,但美国仍然被视为最赚钱的市场之一。
由于对生物仿制药的审批和监管措施、生物仿制药开发和商业化的高成本以及整个生物仿制药生产和审批的复杂性的担忧,Kalorama Information预测只有有限数量的公司将进入这一市场。因此,涉足该领域的公司可能会面临其他仿制药公司的有限竞争,大部分竞争来自原研药企。
参考:
1、关于价值62亿美元的生物仿制药行业需要知道的五件事
2、生物制药行业抵制生物仿制药的4种方式
