Daratumumab是第一个被批准用于治疗多发性骨髓瘤的单克隆抗体,也是同类中第一个抗CD38单克隆抗体。它于2015年11月16日首次获得FDA批准,作为单一药物用于已接受蛋白酶体抑制剂和免疫调节剂治疗的复发性多发性骨髓瘤(MM)患者的第四线治疗。之后,2016年11月被FDA批准联合地塞米松、来那度胺或硼替佐米用于MM二线治疗,2017年6月被FDA批准联合地塞米松和泊马度胺用于MM三线治疗。
1月19日,丹麦生物技术公司Genmab宣布,FDA在让桑提交的daratumumab联合硼替佐米、美法仑、泼尼松一线治疗方案中,对不适合自体干细胞移植的MM患者授予sBLA的优先评价资格。PDUFA的预定审批截止日期为2018年5月21日。
杨森提交这份sBAL是基于一项随机、开放标签、多中心、III期ALCYONE研究的结果,该研究对706名不适合自体干细胞移植的MM患者进行了研究。在ALCYONE研究中,患者随机接受VMP(硼替佐米芬泼尼松)或VMP达拉妥单抗治疗9个周期。Daratumumab组在9个周期后继续使用16mg/kgdaratumumab,每4周1次,直至疾病进展。这项研究的主要终点是PFS,结果发表在ASH2017会议上,发表于《新英格兰医学杂志》。
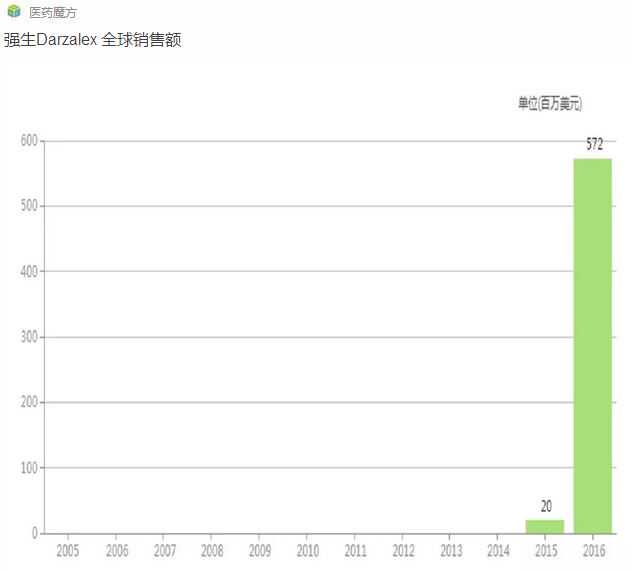
2012年8月,让桑公司与Genmab达成合作协议,以5000万美元预付款、8000万美元收购Genmab公司10.7%股份和10亿美元里程的代价获得daratumumab的全球独家开发权和商业权。daratumumab 2016年全球销售额为5.72亿美元,预计年销售额峰值可超过50亿美元。
多发性骨髓瘤的肿瘤细胞起源于骨髓中的浆细胞(B淋巴细胞发育到最终功能阶段)。它是一种无法治愈的血液癌症,以反复复发和缓解为特征,约占所有癌症患者的1%。它是继白血病和淋巴瘤之后美国第三常见的中间血道。美国每年新增确诊患者30330例,死亡患者12650例。欧洲每年新增确诊病例约3.9万例,死亡2.4万例。全球每年新增确诊病例约124225例。

