我们在生活中经常会遇到以下情况:
家里的孩子,不管是孩子还是小孩,大多都不愿意服用片剂药物,宁死不屈;家长也担心孩子吃药卡在喉咙里,风险大于收益。但此时没有其他适合服用的药物,如口服液、糖浆剂、颗粒剂、分散片等。
市面上只有5mg的药物,但临床使用需要3mg或6mg。
有些患者可能会对药物中的某种着色剂产生过敏反应,但如果没有这种着色剂,他们就无法获得其他同类药物。
除了第一项,虽然这些问题出现的概率很小,但也反映了临床上的一些潜在需求,包括小众需求。基于我国面前的药品管理体制,有两种解决方案。一个是医院的院内制剂,但也有很多制约因素。我们只能建议申请人通过改变剂型、增加规格、改变处方等方式对药品进行“改良”。但仅针对少部分患者的临床需求,就需要申请产品变更,耗费大量人力物力。这里面包括产品变更的申请费用,大的涉及临床费用。申请人没有动力做这种吃力不讨好的事情。这时候怎么处理这件事?
首先,让我们向FDA学习。其实FDA的处理方式也很简单有效,就是允许配药,这是《联邦食品药品化妆品法案》(FDCA)第503A条(配药药房制剂)和第503B条(配药现场制剂)的规定。在美国,医院药房和社会药房配药,或者委托外包站点配药。没必要批准,也就是说,免于批准。但是,FDA保留分配场地进行检查的权利,并将对不符合要求的场地发出警告信并采取监管措施。
2018年1月18日,FDA针对503A和503B条款中“实质上是已批准药物的副本”分别发布了行业指南,进行了详细解释。笔者重点针对503A的新指南《Compounded Drug Products That Are Essentially Copies of a Commercially Available Drug Product Under Section 503A of the Federal Food, Drug, and Cosmetic Act》,对指南内容进行了梳理,旨在将指南中的干货精华以最通俗流畅的方式传递给读者。新指南503B的内容与它们更相似,因此读者可以自己了解它们。在介绍新指南的内容之前,笔者通过互联网搜索和文献搜索发现,关于FDA 503 a和503B条款的介绍很少。因此,本文首先简要介绍第503a和503B条作为背景。
FDA 503A和503B条款的简介
503A和503B都是与配药要求有关的条款。调剂药品的目的是为了解决上市药品无法满足上述某些特定个体患者临床需求的问题。然而,对药物的调配有严格的要求,必须由注册药剂师、注册医生或在外包场所,在注册药剂师的监督下,通过组合、混合或改变药物的成分来进行。
由于配制的药物不需要FDA批准,这意味着它们在FDA上市前没有进行安全性、有效性和质量审查。
根据第503A条,注册药剂师和注册医生配药不需要遵守CGMP。
FDA不与大多数注册药剂师和配药的注册医生沟通。
因此,除非收到投诉,如严重不良事件或明显污染的报告,否则FDA通常不会意识到配药或配药过程的潜在问题。然而,在实践中经常发现,所配药品的标签往往遗漏了确保安全用药的信息、不良反应警示和药物相互作用等重要信息。更有甚者,不规范的调配可能导致严重的药品质量问题,如药品污染或药品失效。这可能会对患者造成严重伤害甚至死亡。例如,与2012年真菌性脑膜炎爆发有关的不良事件,其中受污染的注射药物导致60多人死亡,750人感染。
1、503A条款内容简介
第503A条规定,配药必须由州许可的药房或联邦场所的注册药剂师或注册医师进行,且配药必须基于特定患者的有效处方。符合这一要求的药物可以免除以下三项FDA要求:
01 (a) (2) (b) —— CGMP要求
02 (f) (1) ——药品标签使用的适当说明
505——NDA或ANDA申请
除了FDA保留一些权力外,根据第503A条配药的药房主要由国家药房委员会监管。
2、503B条款内容简介
《药品质量和安全法案》,2013年11月通过,是FDCA中的新条款,增加了外包场地的概念。外包场所是指从事无菌药品调剂的地理位置或地址,该场所已在FDA注册并符合503B的所有要求。外包网站主要由FDA监管。
调配药品的范围限制
新指南503A侧重于对配方药物无需FDA批准即可直接应用的限制和说明,这也是本文的重点内容。
药品调配针对的是个体化的患者,其医疗需求是上市药品无法满足的。
FDAC的503A条款中对于调配药物的满足条件主要是4条:
由注册药剂师或注册医生准备。
不规则准备
不能过分公式化。
本质上,药品不能是已上市药品的复制品。
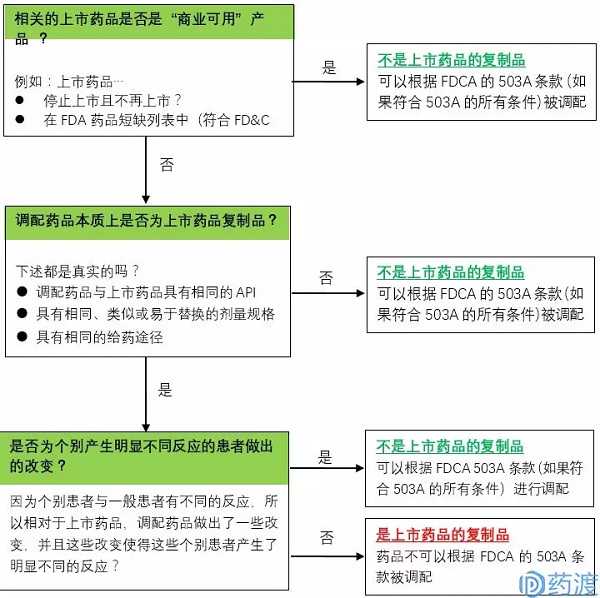
“本质上是上市药品的复制品”不包括为特定个体患者而进行改变的药品,和由处方医生确定的,与上市药品相比,对患者会产生显著差异的药品。
1、对调配药物限制的目的
对配药的限制是为了确保药剂师和医生不会在已经有市售药物的情况下对病人进行不必要的重复配药。
这种“不必要”的制剂将造成重大的公共健康风险,因为它将使患者不必要地接触到尚未被证明安全有效的药物,而这些药物可能是在不符合标准的生产条件下制备的,造成潜在的污染危害。
保护新药的完整性和有效性。
如果在药物被批准后制备了可能更便宜的“复制品”(因为它们不必证明安全性和有效性,也不是根据CGMP要求生产或标记有正确的使用说明),那么申请人不太可能投资和寻求创新的救命药物的开发。
如果允许分配的药物基本上是上市药物的副本,而没有ANDA批准程序,申请人不太可能再次开发和申请仿制药ANDA。因为ANDA必须包括数据证明该药物具有相同的活性成分,并且与批准的药物生物等效;FDA还将对生产设施进行现场检查。这些都是不小的开发成本。
防止非处方药(OTC)钻空子,按照发药路线,不必遵照OTC药品专论标准或CGMP要求生产。
总之,FDAC的503A条款不打算为本质上是上市药品复制品的调配药品提供了豁免审批。换言之,就是避免逐利者利用调配药物药物政策来钻空子,获得或导致破坏社会公平和创新的非法利益,这完全符合美国立法背后的逻辑原则,即先把你假设为坏人,再用法律制度作为限制牢笼,使得坏人无法达到目的。
2、关键术语的官方解释
503A新指南详细解释了一些关键术语,旨在使读者对指南有更详细的理解和实际应用。
首先需要强调的是,药品处方应该是针对特定个体患者做出的变更,与针对该类患者的已上市药品有显著区别。这是为了确保药品制造商不会通过对药品进行相对较小的改变来制造准备好的药品,以将药品提供给公众,而不管开处方者是否确定该改变将对患者产生显著影响。换个角度说,是第一个条件,而不是上市药品的“转变”,即开处方者给患者调配的药品发生显著变化。有了这个认知基础,下面这些术语就比较好理解了。
(1)上市药品
上市药品是指可以通过商业渠道获得,但以下两种情况不符合“市售”条件的药品:
药品已经停产,不再销售。
FDA药品短缺清单中的药品3354 FDA药品短缺数据库中的药品处于“当前短缺”状态(而不是“已解决”状态)。
(2)上市药品的复制品
与上市药品相比,如果同时满足以下条件,FDA在本质上会将调配的药品视为上市药品的复制品。
具有相同的活性药物成分(API);
具有相同、相似或易于替换的剂量规格。
相同的给药途径
上述对配药的限制不仅适用于完全相同的药品,也适用于几乎相同的药品。对上述三个条件的细节逐一进行解释和说明。
相同的API
在某些特定情况下,具有相同API、规格和给药途径的药物可能会对某些特定患者产生重大影响。例如,某些特定患者可能会对上市药物中的非活性成分产生过敏反应,而不含非活性成分的配方药物则不会引起过敏反应。但是,对于这些特定患者以外的患者,上市药物和混合药物可能没有区别。
但如果有的患者对不含过敏非活性成分的药物过敏,而有的患者不过敏,这类配方药物就不允许使用。在剂型和符合规定的情况下,我们一般打算从本质上考虑这类药物,除非处方的改变会对患者产生重大影响。
相同、相似或易于替换的规格。
根据FDA的规定,制备药物和上市药物的相似剂量规格在两种药物剂量规格的10%以内。
关于容易替换的规格,在某些情况下,可以通过使用分剂量或多剂量的药物来实现相同或相似的剂量规格。例如,如果FDA批准的药X片的剂量规格为25mg,患者需要50mg的药X,FDA通常认为配制的药X片具有容易更换的规格,因为患者可以服用两片药X 25mg的片剂来达到所需的剂量。
相同的给药途径
如果配发的药物和上市的药物具有相同的API和相似或容易替换的规格,但只有给药途径不同(例如,如果上市的药物是口服的,配发的药物是本地的),FDA将不承认配发的药物实质上是上市药物的复制品。
如果制备的药物和上市的药物具有相同的API和相似或容易替代的规格,但上市的药物可以使用制备的药物的给药途径(无论如何标示),FDA也会确定制备的药物实质上是上市药物的复制品。因为在这种情况下,与已上市的药物相比,配发的药物通常不会对特定的个体患者产生显著差异。例如,如果上市药物包装在带有肌内注射标签的小瓶中,但是上市药物也可以用较小的针头从小瓶中取出用于皮下给药,那么在这种情况下,具有相同API和相似或容易替换的皮下给药规格的配方药物通常被认为基本上是上市药物的复制品,除非配方药物对特定的个体患者产生显著差异。
与两种或两种以上上市药物具有相同特征。
如果一种配方药物含有两种或两种以上市售药物,具有相同的API、相似或易于替代的规格以及相同的给药途径,FDA将确定该配方药物实质上是该市售药物的仿制品。例如,如果药品X和药品Y为可口服上市药品,且配制的口服药品在药品X和药品Y规格的10%范围内,则DA会认为配制的药品实质上是已上市药品的复制品。除非在分配的药物和特定的单个患者之间存在显著差异。
(2)显著差异声明
如果药品经销商为某个特定患者更换药品,且处方医生已确定该变更将对此类患者产生显著影响,则FDA不会认为此类配制药品本质上是已上市药品的仿制品。然而,配药者应该确保处方记录所配药对患者有显著的不同。
FDA认为,不需要特定的格式来记录,只要处方明确地向患者指出相关的变化以及这些变化的显著差异即可。例如:
“无染料X,患者过敏”(如果造影剂含有染料)
“在液体形式下,患者不能吞咽片剂”(如果对比药物是片剂)
“6毫克,患者需要更高的剂量”(如果对比药物只有5毫克剂量)
但是,如果处方只能识别患者姓名和药物制剂,则不足以证明所配制的药物符合503A(b)(2)中所述的要求。
还需要注意的是,除了上市药品产品变更之外的其他因素,如价格降低等,不足以证明配发的药品本质上不是上市药品的复制品。
(3)短缺药品
如果配发的药物列在FDA的药物缺货清单上,处方医师或处方医师应指出该药物是否列在药物缺货清单上,并注明日期
如果一种药物是“由药剂师或医生定期或过度配制”的药物,并且本质上是已上市药物的复制品,则不符合503A的豁免条件。简而言之,不能定期或经常部署——即不能定期部署,部署量也不能过量。
需要注意的是,如果配发的药品本质上不是已上市药品的仿制品,则不涉及常规或过量供应。例如,与FDA断货清单上的药物产品具有相同API、剂量规格和给药途径的配方药物产品基本上不会被视为上市药物的副本,因为该药物此时不被认为是市售的。
(4)定期或以不合理的数量
应保留记录,以表明已确定所分配药物的变化对特定患者有显著差异。
还应保持药物分配的频率,以证明这种分配不是定期或过度进行的。
FDA建议将上述部署记录至少保存三年。
(5)记录保存
根据《联邦食品、药品化妆品法案》 (FDCA)503A,这是FDA如何确定分配的药物是否是上市药物的复制品的决策树。
参考
1.根据联邦食品、药品和化妆品法案第503A节,FDA对工业合成药物产品的指导,这些药物产品基本上是市售药物产品的复制品。2018.1
2.根据联邦食品、药品和化妆品法案第503B节,FDA对工业合成药物产品的指导,这些药物产品基本上是市售药物产品的复制品。2018.1