创新药物研发是中国从制药大国走向制药强国的必由之路。无论是“863计划”、“973计划”,还是今天的“国家科技重大专项”,国家都对新药的研发寄予厚望,并给予各种鼓励和支持。国内药企也不负众望,共同肩负创造新药的重任。经过多年的积累,拥有自主知识产权的新药产品已经诞生并成功投放市场。“中国一类”新药家族逐渐壮大,我国新药自主创新能力百花齐放。本文将重点介绍近年来国内批准上市的“中国一类”大分子生物药,希望对您有所裨益。
近年,我国批准上市的“中国1类”大分子生物药有哪些?
通过对药物交叉数据和其他专业数据库的联合查询和汇总,自2001年以来,中国本土企业自主研发并获得食品药品监督管理局批准的“中国一类”大分子生物药有23个。详见下表1。
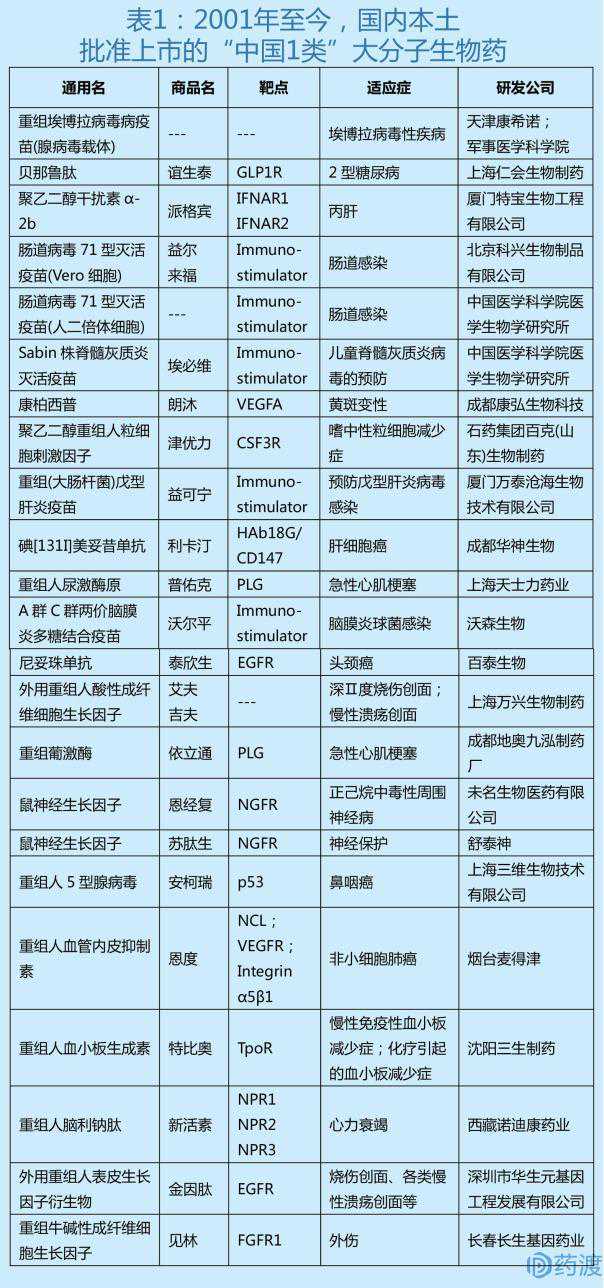
批准的“中国一类”高分子生物药物简介
1) 重组埃博拉病毒病疫苗
由军事医学科学院生物工程研究所和天津康希诺生物有限公司联合研制的重组埃博拉病毒疫苗(腺病毒载体),具有完全自主知识产权。它于2017年10月获得CFDA批准,是一类预防用生物制品。本品为复制缺陷型人腺病毒5型,可表达扎伊尔埃博拉病毒包膜糖蛋白基因。它是用适当的稳定剂通过放大、纯化和冷冻干燥制成的。它是一个乳白色的松散体。接种后可使机体产生免疫反应,用于预防埃博拉病毒引起的埃博拉病毒病。自2015年2月CFDA受理该产品临床试验申请后,总局立即启动特别审批程序,成立专门工作组,同步开展现场核查、技术审评和样品检验工作。同年2月13日批准了该产品的临床试验。世界卫生组织已邀请中国药品监督管理部门和R&D团队赴日内瓦参加埃博拉疫情防控专题讨论,并将该疫苗列入世界卫生组织埃博拉病毒疫苗质量、安全和有效性指南。2017年4月,该品种正式申报生产注册,美国食品药品监督管理局总局随即将申请进入优先审查程序。在技术审查过程中,组织了多次沟通会和专家会议,就注册过程中的问题与申请人进行了充分沟通,确保了产品R&D注册的顺利开展。2017年,CFDA正式批准该品种上市申请,这也是中国首个获批的重组埃博拉病毒疫苗。
2) 贝那鲁肽注射液(谊生泰)
贝鲁肽注射液由上海任慧生物制药公司历时18年自主研发,是我国糖尿病领域首个原创性生物新药(中药除外),也是全球首个全人类氨基酸序列的GLP-1药物。它于2016年12月获得CFDA批准,其适应症为二型糖尿病。它由该公司在中国市场销售,商品名为益生泰。贝糖肽是一种重组人胰高血糖素多肽-1,本质上是一种肠促胰岛素分泌肽,能促进葡萄糖依赖型胰岛素的释放,减少胰高血糖素的分泌。该药对二型糖尿病患者最明显的治疗作用是在没有低血糖风险的情况下有效降低患者的血糖水平,并显著降低体重指数,改善血脂水平。与同类进口药物相比,由于其人性化,长期使用后产生抗体的风险更低。PS:益生泰初始剂量为0.1mg (50ul),每日三次,饭前5分钟皮下注射。注射部位可以选择腹部、大腿或上臂。治疗2周后,剂量应增加至每次0.2mg (100ul),每日3次。
3) 聚乙二醇干扰素-2b(派格宾)
聚乙二醇干扰素-2b,由厦门特保生物工程有限公司历时14年研发成功,是国内首个获得中国批准的长效干扰素。它于2016年9月获得CFDA批准,用于治疗成人慢性丙型肝炎,商品名为Pegbin。该药物为40kDY聚乙二醇化重组干扰素。慢性丙型肝炎三期治疗临床试验中期结果显示,慢性丙型肝炎患者病毒应答率高。该项目是国家“十一五”、“十二五”新药创制重大临床研究项目,厦门特保已获得美国、欧洲、日本、澳大利亚、中国等近30个国家的专利授权。PS:派格宾推荐剂量为每次180g,每周一次,腹部或大腿皮下注射;联合治疗中口服利巴韦林。
4) 肠道病毒71型灭活疫苗
肠道病毒71型灭活疫苗是我国自主研发的预防用生物制品一类新药。2015年有两个品种获批上市,分别是中国医学科学院医学生物研究所生产的肠道病毒71型灭活疫苗(人二倍体细胞)和北京科兴生物制品有限公司生产的肠道病毒71型灭活疫苗(Vero细胞),该疫苗的问世对有效降低我国儿童手足口病发病率,特别是减少该病重症病例和死亡病例,保护我国儿童生命健康具有重要意义。
中国医学科学院医学生物研究所自主研发的国家预防用生物制品一类新药肠道病毒71型(EV71)灭活疫苗(人二倍体细胞)于2015年12月获得CFDA批准的新药证书和生产编号。2016年3月15日,首批疫苗出具合格报告,2016年3月22日在北京正式举行首次接种仪式。所研制的EV71灭活疫苗(人二倍体细胞)是唯一由人细胞基质生产的EV71疫苗产品。该疫苗用于预防EV71感染引起的手足口病。上市前临床研究数据显示,预防EV71引起的手足口病保护率为97.3%,预防EV71引起的重症手足口病保护率为100.0%。PS:接种对象为6个月至5岁儿童,基础免疫程序为2剂,间隔1个月;人用剂量为0.5ml,该疫苗推荐上臂三角肌肌肉注射。
北京科兴生物制品有限公司生产的肠道病毒71型灭活疫苗(Vero细胞),商品名为伊尔来福,于2016年1月获准上市。研发历时8年,投资5亿人民币,用于预防6个月至3岁婴幼儿肠道病毒71型(EV71)引起的手足口病。
5) Sabin株脊髓灰质炎灭活疫苗(埃必维)
中国医学科学院医学生物学研究所近30年研制的Sabin株脊髓灰质炎灭活疫苗,是世界上首个Sabin株脊髓灰质炎灭活疫苗。它于2015年1月获得CFDA批准,临床用于预防儿童脊髓灰质炎病毒感染。它的商品名是Ebivi。该疫苗采用目前脊髓灰质炎减毒活疫苗的生产毒株(Sabin株),在Vero细胞生物反应器中培养和收获病毒,结合灭活疫苗的生产工艺制备而成。它的上市将对中国彻底根除脊髓灰质炎起到至关重要的作用。PS:每瓶0.5ml,每剂0.5ml;每剂病毒抗原量应不低于:型30DU,型32DU,型45DU;建议最好的注射途径是肌肉注射。婴儿肌肉注射的最佳部位是大腿前外侧中部,而儿童、青少年和成人则是三角肌。剂量:根据本品在国内的临床试验结果,推荐常规免疫方案,2、3、4月龄基础免疫,每次0.5mL,18月龄加强免疫(即第一次加强免疫),每次0.5mL。
6) 康柏西普(郎沐)
Percival由成都康弘生物科技有限公司研发,于2013年11月获得CFDA批准,由成都康弘生物科技有限公司在中国市场销售。用于治疗新生血管性(湿性)年龄相关性黄斑变性。是我国第一个自主研发的治疗该病的药物,商品名为浪木。Percival是中国仓鼠卵巢(CHO)细胞表达系统产生的重组融合蛋白(由人血管内皮生长因子VEGF受体1的免疫球蛋白样区2和VEGF受体2的免疫球蛋白样区3和4与人免疫球蛋白Fc片段融合而成),可通过阻断VEGF与内皮细胞表面受体的结合来抑制新生血管的形成。值得一提的是,获得新药专项支持的康弘郎姆,获得临床一期、二期研究豁免,直接获得“FDA三期注册临床研究”,成为我国医疗创新史上的里程碑事件。PS:朗沐是玻璃体内注射用的溶液,每支含10mg/mL康柏西普;推荐剂量为前3个月每月0.5mg/眼,以后每3个月1次。
7) 聚乙二醇化重组人粒细胞刺激因子注射液(津优力)
优诺康拜克(山东)生物制药有限公司研发的聚乙二醇化重组人粒细胞刺激因子注射液于2012年3月获得CFDA批准。它在临床上用于预防化疗后的常见疾病中性粒细胞减少症,其商品名为金宥利。金力的作用机制是粒细胞刺激因子与造血细胞表面受体结合,刺激增殖,阻止功能活化细胞的增殖。对受体结合机制和中性粒细胞功能的研究表明,PEG-rhG-CSF和rhG-CSF具有相同的作用机制。与rhG-CSF相比,PEG-rhG-CSF可降低血浆清除率,延长半衰期。PS:化疗结束后48小时皮下注射金宥利,推荐剂量为100g/kg,每个化疗周期1次;100g/kg的剂量不能用于婴儿、儿童和体重低于45kg的未成年人。
8) 重组(大肠杆菌)戊型肝炎疫苗(益可宁)
由厦门万泰沧海生物科技有限公司研发的重组(大肠杆菌)戊型肝炎疫苗是世界上第一个获得批准的戊型肝炎疫苗。它于2011年12月获得CFDA批准,临床用于预防戊型肝炎病毒感染。它的商品名是易克宁。重组(大肠杆菌)戊型肝炎疫苗研发14年,累计投入约5亿元。具有高度原创性,拥有完全自主的知识产权。先后获得国家863计划、国家科技型中小企业创新基金、国际科技合作计划、国家科技重大专项(传染病防治)、福建省科技重大专项、厦门市工业科技重大专项等项目支持。PS:0.5ml重组戊型肝炎疫苗含30微克蛋白病毒颗粒。
9) 碘[131I]美妥昔单抗(利卡汀)
由成都华神生物技术有限公司研发的碘[131I]美托昔单抗于2011年5月获得CFDA批准。用于治疗肝细胞癌,商品名Riccatin。碘[131I]美托昔单抗是用碘131标记的抗HAb18G/CD147单克隆抗体。是国家火炬计划国家重点新产品,科技部收入。它是世界上第一个批准上市的用于治疗晚期肝细胞癌的放射免疫分析靶向药物。PS:瑞卡汀是注射剂。推荐剂量为每次27.75MBq/kg (0.75mCi/kg),每次给药间隔至少4周。
10) 注射用重组人尿激酶原(普佑克)
由上海天士力制药有限公司研发的具有自主知识产权的注射用重组人尿激酶原,是国家“十一五”规划“重大新药创制”重大科技项目。它于2011年4月获得CFDA批准,临床用于治疗急性心肌梗死。它的商品名是普优克。普优克是尿激酶的前体,进入血液后没有活性。它吸附在血栓表面后,被激肽释放酶激活,然后转化为尿激酶,起到溶栓作用。具有明显的血栓定位特异性。PS:普优克为静脉注射液,每支含尿激酶原5mg推荐剂量为每次50mg,第一次20mg在3分钟内静脉注射,其余30mg在30分钟内静脉滴注。
11) 冻干A、C群脑膜炎球菌多糖结合疫苗(沃尔平)
由云南沃森生物研发的冻干A群和C群脑膜炎球菌多糖结合疫苗于2009年1月在中国获得CFDA批准。临床上用于预防A群和C群脑膜炎球菌引起的流行性脑脊髓膜炎,商品名为Volpin。将a群和c群脑膜炎球菌多糖与疫苗a群和c群脑膜炎球菌培养液结合,分别提取和纯化a群和c群脑膜炎球菌荚膜多糖抗原,混合后加入乳糖作为稳定剂,冻干制成疫苗,可使机体产生体液免疫应答。PS:溶解后每瓶0.5ml,剂量为每人一次0.5ml,含A组和C组脑膜炎球菌荚膜多糖各50g。
12) 尼妥珠单抗(泰欣生)
尼妥珠单抗由百泰生物制药有限公司开发,并于2008年1月获得中国美国食品药品监督管理局批准,由Biocon、BioTech和其他一些公司联合开发和销售。临床上用于头颈癌的治疗,商品名为泰新生。尼妥珠单抗是世界上第一个靶向EGFR的人源化单克隆抗体药物,能特异性结合正常细胞和肿瘤细胞上的表皮生长因子受体(EGFR),竞争性抑制EGF和其他配体(如转化生长因子)与该受体的结合。PS:泰欣生为静脉注射用溶液,每瓶(10mL)含50mg尼妥珠单抗;推荐剂量为第一次放疗前100mg,静脉滴注60分钟以上,之后每周一次100mg,共八次。
13) 外用重组人酸性成纤维细胞生长因子(艾夫吉夫)
由上海万兴生物制药有限公司与暨南大学生物医药技术研发中心合作,台湾安立信生物医药股份有限公司联合开发的外用重组人酸性成纤维细胞生长因子,于2007年1月获得CFDA批准。临床上用于治疗深二度烧伤创面和慢性溃疡创面,商品名为艾福吉夫。酸性成纤维细胞生长因子(aFGF)是成纤维细胞生长因子家族的一员,能促进来源于中胚层和神经外胚层的细胞分裂,主要分布在大脑中。以自分泌或旁分泌的形式作用于周围细胞,但缺乏信号肽结构。AFGF由大肠杆菌表达,是一种多功能细胞生长因子。可用于治疗急慢性皮肤溃疡、创伤、烧伤,还能平衡色素分布,改善肤色,抚平皱纹,滋润皮肤。PS:Evgiff规格为25000 U/瓶,每瓶冻干粉量为2mL将此包装中配制的10ml溶剂倒入装有thaFGF冻干粉的瓶中,盖上(卡上)包装中配制的喷头,即可开始使用;清创后将药液直接喷在受伤部位,或用大小合适的无菌纱布覆盖在受伤部位,将药液均匀滴在纱布上,并妥善包扎。每天换药一次,或遵医嘱;对于烧伤创面,最长用药时间不得超过3周,对于慢性溃疡创面,最长用药时间不得超过6周。
14) 重组葡激酶(依立通)
重组葡激酶由成都地奥红九制药有限公司研发,于2006年12月获得CFDA批准。临床上用于治疗急性心肌梗塞,商品名伊利通。重组葡激酶是基因工程制备的新型溶栓药物,用于治疗血栓形成引起的急性心肌梗死,在治疗外周血管血栓形成和血栓形成引起的缺血性组织坏死疾病方面具有应用前景。还可以开发成预防和治疗血栓形成的药物。与链激酶、重组链激酶、尿激酶、组织型纤溶酶原激活剂相比,具有溶栓快、毒性低、成本低、易于生产的优点。PS:伊立酮需要静脉给药,每瓶含5mg重组葡激酶;推荐剂量为每次500000AU,30分钟内滴注完毕。
15) 注射用鼠神经生长因子
鼠神经生长因子,国内共有两家企业获得了该品种的一类新药证书,分别是伟明生物医药有限公司的“恩京福”和舒泰神的“苏泰生”。伟明生物医药有限公司研发的鼠神经生长因子于2006年6月通过CFDA批准(福建省首个1类新药),临床用于正己烷引起的周围神经病变的治疗,商品名为恩京福。与国内外其他神经营养药物相比,恩静复具有更高的药物经济学。恩静复作为神经损伤的直接治疗药物,能有效促进患者运动和感觉功能的恢复,降低患者的致残率,给患者带来更高的生活质量。PS:恩静复为肌内注射液,每支含18g (9000U)冻干粉;推荐剂量为每次1片,每天1次,4周为一个疗程。
苏泰生由舒泰神和北京赵岩新药研究中心联合申报,并于2006年4月获得CFDA批准。用于治疗视神经损伤,由舒泰神在中国市场销售。舒泰神的主要产品苏泰生是具有自主知识产权的国家新药。含有鼠神经生长因子,能保护神经元,促进轴突定向再生和髓鞘形成。除了临床应用于治疗视神经损伤,CFDA还批准了糖尿病足的临床试验。PS:苏太生是肌内注射,每瓶含30g(生物活性15000 AU)鼠神经生长因子;推荐剂量为每次30g,每日一次,3-6周为一个疗程。
16) 重组人5型腺病毒(安柯瑞)
由上海三维生物技术有限公司研发的重组人5型腺病毒于2006年4月获得CFDA批准。它在临床上用于治疗对常规放疗或放疗加化疗无效,并接受5-FU和顺铂化疗的晚期鼻咽癌患者。它的商标名是安克瑞。安克瑞是一种重组腺病毒5型产品,删除了病毒的E1B-55KD和E3基因,以减少肿瘤细胞内p53蛋白的降解,促进肿瘤崩解。与野生型病毒相比,本品的病毒复制能力较低。PS:安可瑞为瘤内注射液,每支含5.010(11次方)vp/0.5mL病毒悬液;本品应与化疗药物同时使用,每次5.010(11次方)vp ~ 1.510(12次方)VP,每日1次,连续5天,第21天为一个周期,最多5个周期。
17) 重组人血管内皮抑制素(恩度)
重组人血管内皮抑制素由烟台麦德欣研发,于2005年9月获得CFDA批准。在中国,它与长春瑞滨/顺铂联合用于治疗晚期非小细胞肺癌(NSCLC)。目前其抗血管生成联合化疗已成为我国晚期非小细胞肺癌一线治疗的标准方案,商品名为Endo。内皮抑素是在内皮抑素的基础上增加9个氨基酸研制的1.1类抗肿瘤血管靶向药物,具有自主国家知识产权。本品联合NP化疗方案用于治疗初治或复治/期非小细胞肺癌患者。PS:本品静脉给药。使用时,将本品加入500毫升生理盐水中,匀速静脉滴注3 ~ 4小时。当与NP化疗方案联合使用时,在继续下一个治疗周期之前,从治疗周期的第1天到第14天,每天一次服用本品7.5mg/m2 (1.2105U/m2),连续服用14天,休息一周。通常可进行2 ~ 4个周期的治疗;在患者能够耐受的情况下,建议临床医生延长本品的使用时间。
18) 重组人血小板生成素(特比奥)
三生制药历时8年研发的重组人血小板生成素于2005年5月获得CFDA批准。临床上用于治疗化疗引起的血小板减少症和免疫性血小板减少症,商品名为特比奥。特比奥是一种重组人血小板生成素,可以刺激巨核细胞的产生和分化,释放成熟血小板,增加血液中循环血小板的数量。该项目于1997年被列入“863计划”,2001年被列为国家“十五”重大科技项目。PS:特比奥为皮下注射,每瓶(1mL)含重组人血小板生成素7500U或15000U推荐剂量为300U/kg,每天一次,连续14天。
19) 重组人脑利钠肽(新活素)
重组人脑利钠肽由西藏诺迪康制药有限公司研制,于2005年4月获得CFDA批准。临床上用于治疗急性失代偿性心力衰竭,静息或轻活动时呼吸困难,商品名苏。新的激活素可以与利钠肽受体结合,引起细胞内cGMP浓度的增加和平滑肌细胞的舒张。cGMP升高可扩张动静脉,降低动脉压和右心房压,从而减轻心脏的前后负荷,迅速缓解心力衰竭患者的呼吸困难和全身症状。2008年,康哲药业有限公司获得了新活性成分产品的独家代理权。凭借在医院终端市场推广上的优势,迅速将新活性成分打造成为销售额过亿的品种。PS:新激活剂需静脉给药,每瓶含0.5mg/500U重组人脑利钠肽冻干粉;推荐剂量为先负荷剂量1.5g/kg,然后以0.0075g/kg/min的速度持续滴注24小时。
20) 外用重组人表皮生长因子衍生物(金因肽)
外用重组人表皮生长因子衍生物由深圳华生源基因工程发展有限公司研发,中国工程院院士盛智勇教授称赞其为“伤口修复的一朵奇葩”。2001年5月获CFDA批准,临床适应症为烧伤创面、各种慢性溃疡创面等。它的商品名是黄金肽。深圳华生源基因工程发展有限公司采用国际先进的基因重组技术,在GMP认证生产基地成功产业化重组人表皮生长因子(HGF)。其分子结构和生物活性与内源性人表皮生长因子高度一致。在国家美国食品药品监督管理局组织的多中心临床药理研究中发现,HGF具有促进创面愈合、减少创面渗出、提高修复质量的独特临床作用。PS:活性成分为重组人表皮生长因子(rhEGF),以10%甘油和1.0甘露醇为保护剂,规格为(1) 2000IU/ml、5ml/支(2) 2000IU/ml、15ml/支;常规清创后,将本品局部均匀喷洒于伤口,每日一次,每次200IUrhEGF左右,然后根据伤口需要做相应处理。
21) 重组牛碱性成纤维细胞生长因子(见林)
长春长生基因制药有限公司研制的重组牛碱性成纤维细胞生长因子于2001年4月通过中国美国食品药品监督管理局批准。临床上用于伤口愈合,商品名健林。林能可刺激来源于中胚层和神经外胚层的细胞生长,如成纤维细胞、血管内皮细胞、上皮细胞等。并能促进伤口愈合。用于治疗烧伤创面(包括浅度、深度、肉芽创面)、慢性创面(包括体表慢性溃疡)等。)和新鲜伤口(包括外伤、供皮伤口、手术伤等。).PS:健林为冻干粉针剂,每支含重组牛碱性成纤维细胞生长冻干粉35000IU使用时,将冻干粉溶于2ml溶剂中,置于喷雾瓶内,用大小合适的无菌双层脱脂纱布覆盖患处,将药液充分均匀地喷洒在纱布上,包扎好。一天换一次药,还是遵医嘱。推荐剂量为120-150Au/cm2。
参考:
1.药物交叉数据
2.各大药企官网信息
