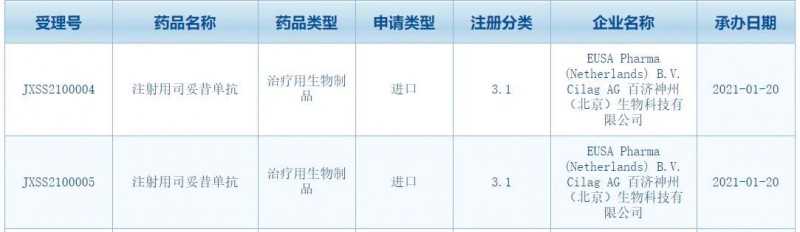
根据中国美国食品药品监督管理局药物评价中心(CDE)的最新公告,EUSA医药和百济神州联合提交了两份IL-6抑制剂注射用丝妥昔单抗的上市申请,并于1月20日获得受理。值得一提的是,这款药物在一周前刚刚被CDE列入准优先评价,其适应症为“用于治疗人类免疫缺陷病毒(HIV)阴性、人类疱疹病毒8型(HHV-8型)阴性的成人多中心卡斯特曼病(polycentric Castleman's disease)。
多中心Castleman病是一种罕见的危及生命的消耗性淋巴组织疾病,可产生免疫细胞的异常增殖,在症状和组织学特征上与淋巴瘤有许多相似之处。患者可有不同症状:有的只是单个淋巴结异常,伴有轻度流感样症状;严重的包括多处淋巴结异常,血细胞数量异常,器官功能异常,危及生命。研究表明,白细胞介素-6(IL-6)的变化可能是该疾病的关键驱动因素。
斯托昔单抗是一种IL-6抑制剂,最初由强生公司开发,然后许可给EUSA制药。2020年1月,百济神州与EUSA医药达成合作,获得了包括司妥昔单抗在内的两种药物在大中华区的研发和商业化权利。
根据公布的数据,stuximab可用于阻断IL-6的活性,IL-6是一种多功能细胞因子,在多中心Castleman病患者中检测到。自2014年在美国首次获批以来,该产品已在全球40多个国家和地区获批用于治疗HIV阴性和人类疱疹病毒-8阴性的多中心性Castleman病患者。
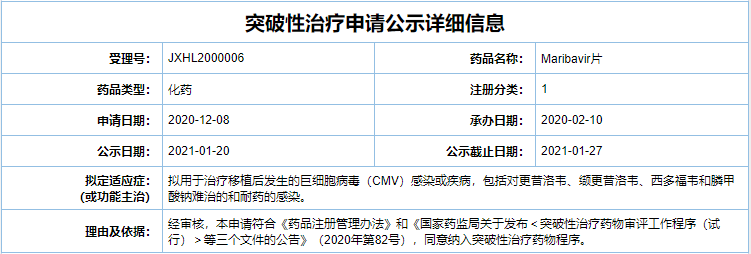
在中国,stuximab被列入罕见病《第一批临床急需境外新药》名单。临床急需海外新药主要指近年来已在欧美、日本上市,但尚未在国内上市的新药。用于治疗罕见病、严重危及生命或严重影响生活质量的疾病,无有效治疗或临床优势明显。对于这些药物,如果申请人研究认为不存在种族差异,可以直接申请在中国上市,NMPA将按照优先审评审批程序加快审评审批。此次,stuximab的上市申请被CDE受理,意味着stuximab有望很快获批在中国上市,这将为Castleman病患者带来治疗选择。
值得一提的是,2020年,CDE接受了另一种药物dinutuximab beta的上市申请,并将其纳入优先审查范围,该药物是由EUSA制药公司与Stutuximab一同推出的。去妥昔单抗是一种针对GD2的单克隆抗体,百济神州拥有在中国大陆开发和商业化该药物的独家权利。该药在中国上市的拟定适应症为:适用于治疗12个月龄的高危神经母细胞瘤患者,以及有或无残留病变的复发性或难治性神经母细胞瘤。
外部引进是生物医药企业拓展管道的重要方式之一。过去几年,百济神舟也通过这种方式推出了一系列在研产品。公开资料显示,2020年,除了EUSA医药,百济神州还与组装生物科学、生物技术、Leap Therapeutics等达成授权合作。涉及的产品包括正在研发的治疗慢性乙肝感染的创新药物、贝伐单抗生物类似物、人源化单克隆抗体DKN-01等。目前,这些进口产品正在取得重大进展。我们期待这些药物早日获批,为患者带来新的治疗选择。
关注药明康德微信官方账号
