别构药物是指那些不直接与蛋白质的活性位点结合,而是与其他位点结合改变蛋白质分子结构,进而产生相应活性的药物分子。近日,Hotspot Therapeutics首席执行官Jonathan Montagu先生在知名博客LifeSciVC上发表了一篇帖子,介绍了诺华的激酶变构抑制剂Asciminib的发现过程,然后阐述了他对变构药物的看法,包括其发展面临的挑战和未来的机遇。

Hotspot Therapeutics首席执行官乔纳森蒙塔古先生(图片来自互联网)
Asciminib,别构类药物的典型代表
在过去,慢性粒细胞白血病(CML)患者的生存期只有3-5年,在此期间,疾病迅速从慢性白血病转变为侵袭性和致命性的急性白血病。幸运的是,自从靶向Abl1的ATP结合活性位点药物格列卫(伊马替尼)于2001年上市以来,CML已经成为靶向癌症治疗的典范。格列卫将慢粒患者的10年生存率提高到84%,创造了一个全新的市场,最高销售额达46亿美元。
毫无疑问,慢粒的治疗已经取得了很大的进展,但大多数患者仍然需要继续使用强效激酶抑制剂。此外,当部分患者出现T315I等突变时,只能使用黑框药物Iclusig(Ponatinib)继续治疗。在激酶变构抑制剂出现之前,相关治疗领域的研究进展已经停止了一段时间。
2017年3月,诺华公布了针对Abl1的全新致癌融合药物ASCMINIB (ABL-001)的实验数据。一般靶向Abl1的分子被设计成直接与活性位点结合,而Asciminib作为一种别构抑制剂,靶向激酶的非活性位点,其作用机制模仿了蛋白质调节的天然机制,只是在末端增加了一条脂肪链。

x射线晶体结构:ABL001(红色)和尼罗替尼(紫色)分别针对激酶的口袋结构。
由于其独特的作用机制,与传统疗法相比,它对T315I突变肿瘤具有更显著的活性。早期临床研究的结果表明,对其他激酶抑制剂耐药或不耐受的患者在给予Asciminib后得到可靠的抑制。研究人员还发现,一种变构抑制剂加上另一种活性位点抑制剂Asciminib和尼罗替尼的组合达到了近乎完美的治疗效果,可以完全控制异种移植小鼠的癌症发展,并且给药结束后不易复发。
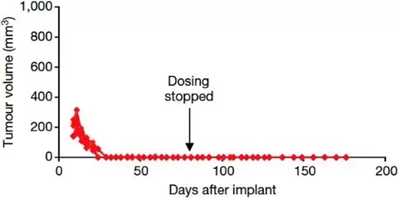
Asciminib(30mg/kg)和Nilotinib(75 mg/kg)的组合在具有移植肿瘤的KCL-22小鼠中的治疗
这不是第一次在临床前模型中发现突破性的联合治疗。许多联合疗法面临的最大问题是,虽然药物联合提高了药物疗效,但也“叠加”了毒性,就像抗CTLA4和BRAF药物联合治疗黑色素瘤一样。这对于Asciminib来说不是问题。作为一种变构抑制剂,Asciminib的口袋结构比活性位点保守得多,提高了药物的选择性。此外,这种具有挑战性的化学空间结构不再是发现相关药物的障碍,因为它避开了激酶的活性位点。
别构类药物发展所面临的挑战
靶向BCR-ABL的变构分子通常具有更好的耐受性。面对如此安全的药物结构诱惑,R&D人员为什么不放弃所有激酶活性位点,而是全部转向别构药物研发?这有几个主要原因。
另一个英文单词“Allostery”来自希腊语allos,意为“其他三维”。变构调节分子不通过活性位点发挥作用,但我们不确定这些变构位点在哪里。找到他们充满了挑战。用目前的分析方法不容易找到这些隐藏的地点。有些口袋结构可以用X射线晶体结构来呈现,但我们不知道这些区域的具体功能。
此外,已建立的药物发现流程大多是为了开发具有活性位点的抑制剂,许多公司都在以活性位点为导向研发相关药物。筛选这类化合物库的高通量筛选方法需要很容易地扩展到百万化合物的分析,优选的规则当然要简单规范,剔除不确定的功能区。当然,不能带来立竿见影效果的项目也很难进行下去。
除了变构位点和药物筛选过程的困难,药物化学家也倾向于更多地关注那些在筛选中容易脱颖而出的活性位点分子。其他种类的分子从一开始不太好的药效到nM级别的构效转化,需要药物化学家付出更多的努力,有时甚至敢于打破利平斯基的药物制备原理,这使得药物化学家对它们敬而远之,宁愿选择活性位点分子,尽管他们知道很多分子只是昙花一现。因此。几十年的惯性努力,让变构药物从一开始就难以接受。
别构类药物的新方向
尽管面临上述挑战,乔纳森先生对别构药物的发展充满希望。随着探索变构分子口袋结构新方法的发展,研究者试图通过探索自然界中蛋白质的调节机制来寻找新的变构位点。如前所述,Asciminib的作用位点与自我调节激酶的作用位点相同。针对这些调控位点,不难发现哪些与蛋白质调控有关。由Nimbus Therapeutics公司的Gerry Harriman领导的乙酰辅酶a羧化酶(ACC)项目是靶向激酶的天然调节位点,旨在寻找选择性高、疗效好的治疗非酒精性脂肪性肝炎(NASH)的变构药物。另一家公司Relay Therapeutics从第一原理解决问题。通过使用特殊的技术,他们可以长时间模拟蛋白质的活动过程,从而发现静态X射线晶体结构方法难以发现的隐藏的变构口袋结构。

虽然传统的基于片段的筛选方法耗时且昂贵,但它有助于发现一些变构口袋结构。几个Wellspring和Shokat团队在Cell杂志上报道了最新的半胱氨酸抑制剂,他们的目标是将突变的半胱氨酸放入KRas的变构口袋结构中。
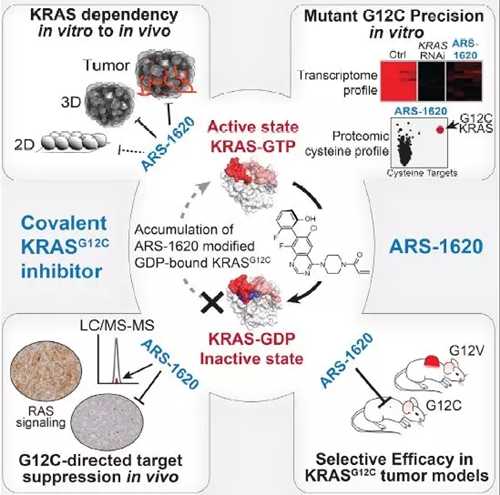
Spring和Shokat团队在《细胞》杂志上发表了针对KRas变构口袋突变的半胱氨酸抑制剂(图片来自参考文章)
如果生物目标能够以其自然的方式展示,可能会帮助我们在化学方面取得更多突破。当诺华最初筛选Abl1靶点时,Markus Warmuth和Nathanael Gray领导的团队认为用老方法筛选激酶口袋区肯定是不可行的。他们选择了细胞置换的方法来研究ABL-001的前体分子GNF2。这种筛选方法提供了具有天然蛋白质长度的BCR-ABL。最近,Phoremost公司使用基于细胞的筛选方法来筛选慢病毒库中携带的数百万个肽。

另外很重要的一点是,化合物库的多样性应该符合变构口袋分子的要求,而不是只包括活性位点分子。例如,最初的GNF2系列来自50k的化合物库,而最近发表的SHP2变构抑制剂则选自100k的分子库。这就告诉我们,要选择最合适的复合库,而不是最大的。此外,成功的别构药物发现需要巧妙的筛选模式,而不是只关注分子是否抑制靶标。诺华团队利用核磁共振确定abl 1 C端螺旋结构的全过程就是很好的证明。
总之,别构药物的发现并非一帆风顺。要实现这个目标,我们需要一个强大而坚定的团队领导,敢于打破药物发现的常规,并能推动相应的灵活可靠的研究方法。对于接受这个挑战的团队来说,奖励也是相当丰厚的。所以,我们要向诺华的团队致敬。正是他们的坚持使Asciminib成为可能,我们可以承诺为慢粒患者提供更好的治疗。
参考文章:
用共价G12C特异性抑制剂靶向喀斯特地貌突变癌症
实现承诺。
变构抑制剂ABL001能够双重靶向BCR-ABL1