文| zhulikou431
作为全球领先的医药市场,中国医药市场一直受到海外制药公司的关注。对境外企业的监督检查也是美国食品药品监督管理局的重点工作之一。2012年开始的海外药企检查是一个开始;随着国家总局法律法规的完善和技术力量的加强,2015年以来,国家总局对境外药企的检查频率和力度不断加强。本文总结了2017年至2019年连续三年的检验数据和信息,供业内同仁参考。
根据国家美国食品药品监督管理局的工作安排,CFDI负责境外企业的考察和跟踪。
第一部分:三年总体检查情况汇总分析
2018年6月,国家局审计检查中心(CFDI)出具《2017年度药品检查报告》。然而,2019年全年,CFDI并未发布任何2018年境外药检相关的举报材料。因此,本文根据CFDI官网和NMAP官网的信息,总结了2018年和2019年的境外药品检查情况。详情见表1。
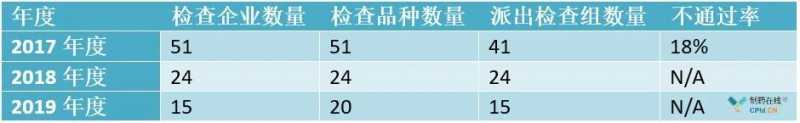
表1-2017-2019年一般检查总结
分析:
1-根据《2017年度药品检查报告》,2017年CFDI共检验51个品种;其中化学药品36种,包括注射剂、固体制剂、粉剂、原料药等。14种疫苗、血液制品、治疗性生物制品和1种植物药。全年境外检验的药品包括申报生产、再注册、补充申请和正常进出口销售的产品。主要集中在欧洲和北美,印度等国的检查次数呈增加趋势。在现场检查的51个品种中,有9个品种被发现不符合GMP要求或不合格。
根据以上数据可以看出,在过去很长一段时间内,主要是欧美药企的产品进口到中国市场,所以中国药监部门对外检查对象多在欧美。印度制药公司作为中国市场一个新的药品供应群体,已经开始引起中国药品管理部门的重视,并开始加大检查力度。
2-由于CFDI没有发布2018年药品检查报告,这部分分析是基于NMPA和CFDI官网检查信息的汇总。与2017年境外检查相比,2018年境外企业检查力度明显减弱;可能是因为吉林长生事件,国内CFDI的资源主要用于国内生物制品企业和疫苗企业的检验。检查范围仍按照以下原则:无菌及生物制品作为高风险产品主要检查,首次进口到我国的药品主要检查。
3-由于是在2020年初,CFDI尚未发布2019年的药品检查报告。这一部分的分析是基于从NMPA和CFDI官方网站收集的考察信息。如果说2018年境外企业检查突然明显减少可能是受吉林长生事件的影响,那么2019年境外企业检查并没有好转,说明国家局机构改革对一些日常工作也产生了明显影响。
第二部分:三年检查重点缺陷问题分析
2.1-2017年海外检查重点问题分析
根据《2017年度药品检查报告》,2017年中国CFDI对境外企业检查过程中,共发现缺陷665项,其中严重缺陷27项,重大缺陷140项。问题主要集中在质量控制和质量保证、文件管理、无菌药品管理等方面。严重缺陷主要包括生产工艺不一致、重大变更未及时向中国报告、注册申报资料真实性问题、生产厂设施设备和生产操作不能有效降低产品污染或混淆风险、不能有效控制不合格产品等。
另外,根据《2017年度药品检查报告》披露的部分失败案例的具体信息,部分外企存在极其严重的合规问题。这里有三个例子值得关注:
1.实际生产过程、生产现场、检验项目等。与注册申报不一致,或有重大变化等。在没有向中国报告的情况下已经实施。例如,在制备注射油相的过程中,实际过滤方法和过滤材料与注册申请资料不一致;放行出口中国的产品未按进口注册标准进行有关物质检查和含量均匀度测定的;改变工艺处方;实际生产的工厂、地址与《进口药品注册证》等标注的工厂、地址不一致。
分析:以上显示的违规事实,既是GMP管理的系统操作,也是境外企业大部分药品生产工艺和关键参数与我国进口药品注册数据不一致的事实。存在严重违规风险,药品质量无法保证,对我国患者健康造成持久影响。上述案例也说明,注册流程不一致的问题不仅在中国企业存在,在海外药企也同样存在,需要引起中国药监部门的深入思考和重视。
2.存在严重的数据可靠性问题。例如,多批次放行测试图谱使用信息备注复制伪造材料作为注册审查提交的材料;现场检查不能提供原始检查记录的;处方样品的试制批号与中间产品和成品的批号不一致,同批样品的试制记录、颗粒含量测定、释放度测定(成品)和含量测定(普通片)不一致。
分析:这个案例所展示的是令人震惊的!可以说这个海外企业没有合规意识和质量文化,完全是欺诈和任性!对于这样的产品和企业,如果不能通过严格的检查发现和屏蔽,将会对中国患者造成严重的伤害。
3.生产设施、设备和生产操作不能有效地降低产品污染或混淆的风险。如水针剂灌装生产线与粉针剂生产线(该生产线有激素类产品)位于同一车间,共用空气净化系统,企业未进行风险评估,未采取有效防护措施避免激素类产品对其他产品的污染;灌装操作人员需要手动将胶塞压入铝盖中,然后放置在灌装好的三腔袋对应的腔口处;厂区内污水和垃圾多;总的来说,生产区灭蚊措施不力,生产厂区常年高温(最高可达45)。没有降温措施,门窗无法关闭;多处纱窗破损,生产现场多处发现蚊虫;多次开放式进料或物料转移操作,无局部保护等。
解析:GMP标准,1962年诞生于美国,主要是为了控制污染、交叉污染,尽量减少人为错误。从上述案例来看,被检查的境外企业对GMP和质量没有基本的认知,存在严重的污染风险,自然应该被打死。
2.2-2018年海外检查重点问题分析
根据官网NMPA和CFDI的信息,笔者将2018年发布的境外药检缺陷汇总如下:
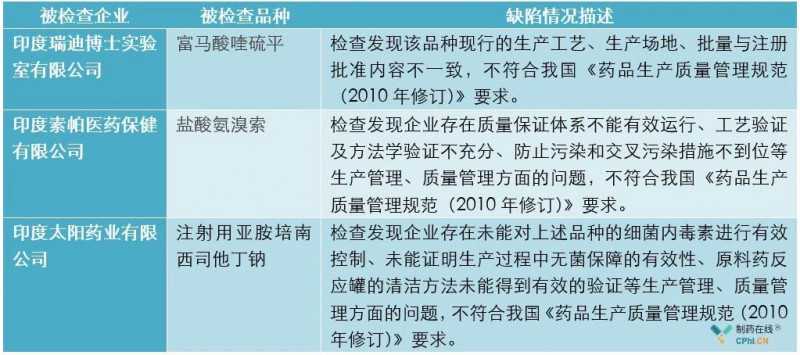
分析:从以上检查缺陷来看,境外企业也存在注册流程与实际流程不符的严重问题;如果放松检查频率,类似风险就很难发现,或者需要很长时间才能发现,给中国患者带来风险。此外,对无菌药品进行更严格的检查是世界各国药监部门的一贯作风,也是产品处于高风险类别的原因。
2.3-2019年海外检查重点问题分析
根据官网NMPA和CFDI的信息,笔者将2019年发布的境外药检缺陷汇总如下:
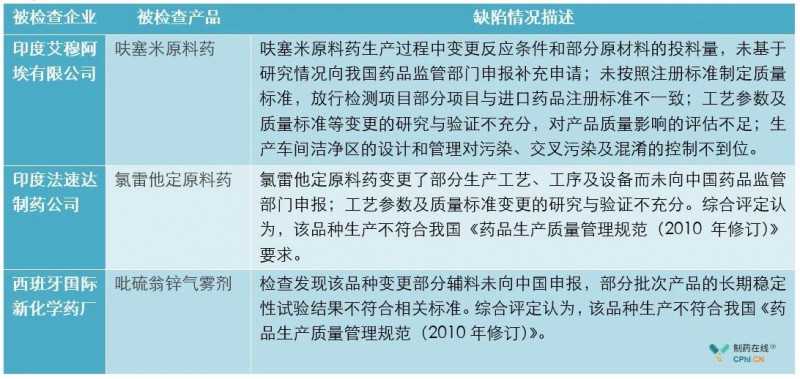
分析:根据2019年公开反映的案例,也普遍存在注册流程与实际流程I不一致的情况
由于国家局尚未发布2018年度药品检查报告,笔者基于CFDI官网信息统计如下:
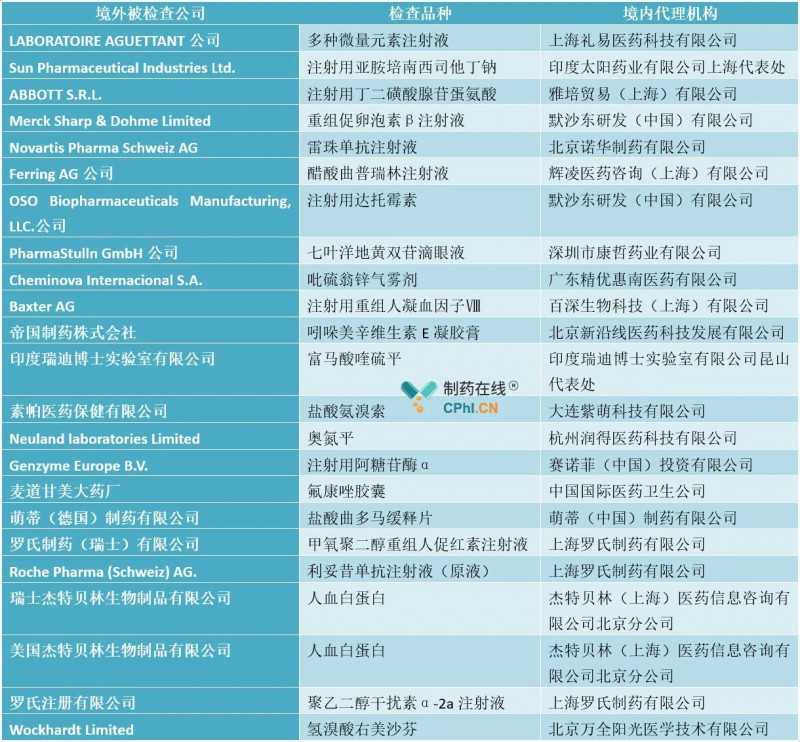
注:上表统计信息日期自2018年1月1日起,至2018年12月31日止。
分析:根据以上统计信息,2018年共有24家企业参与境外检验,共24种产品。与2017年境外检查相比,2018年境外企业检查力度明显减弱;可能是因为吉林长生事件,国内CFDI的资源主要用于国内生物制品企业和疫苗企业的检验。从检查内容看,还是按照以下原则:主要检查无菌制品、生物制品等高风险产品,主要检查首次在中国注册的企业。值得注意的是,对瑞士罗氏公司利妥昔单抗注射液(原液)的检查表明,我国医药管理局对生物制品原液和制剂能否分开的政策有所松动。据笔者所知,仍有不少省局对生物制品的原液和制剂是否允许单独设立生产地址持保守态度,这表明我国的法律法规需要进一步明确和统一,以促进我国企业的快速发展。
3.2-2019海外企业考察总结
2020年初,CFDI 2019年对海外药企的检查报告尚未出炉。根据CFDI官网信息统计,作者如下:
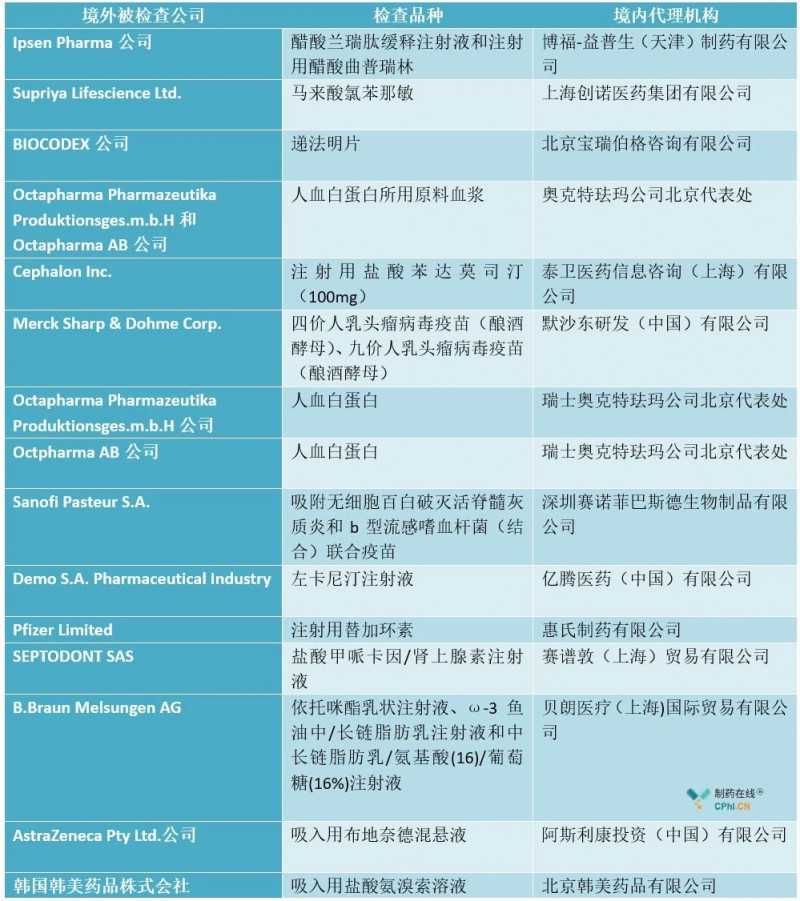
注:上表统计信息日期自2019年1月1日起,至2020年1月11日止。
分析:根据上述2019年检查数据统计,2019年,中国国家美国食品药品监督管理局CFDI开展了15次境外药品检查。涉及20种具体产品。
在20种测试药物中,有两种是低风险产品,即地尔敏片和马来酸氯苯那敏。估计地尔敏片是第一次进口到中国市场,而马来酸氯苯那敏是国内短缺原料,这种原料的前期合成会用到联合国严格控制的中间体(可用于制造武器)。2019年检查的其余18种产品属于高风险产品类别,如注射剂、吸入溶液、生物制品、血液制品等。这些情况也说明CFDI在目前有限的技术力量下,坚持控制高风险产品的基本原则和工作方向。
第四部分:2020年海外考察趋势预测。
据预测,1-CFDI将加强对海外创新药物的检查。
根据以上信息和数据,结合行业发展趋势,随着更多全球创新药物在中国市场注册,美国食品药品监督管理局CFDI客观上面临更多的检验任务。2019年批准的国外创新产品,很多都没有经过现场和GMP检查,这显然是不合适的。这种情况应该在2020年有所调整。
2-CFDI将继续加强对高风险产品的检查。
对于高风险产品(血液制品、生物制品、无菌制品等。),这是国家局CFDI将保持不变的方向。应该说这个考察方向对国内外药企都是平等的。但考虑到2018年年中以来国内多家著名无菌药企被欧美警告,预测2020年中国在海外进行无菌检查时将保持高压态势。
3-CFDI将根据国内抽样情况判断检验方向。
虽然从2019年国家局公布的上市药品抽查情况来看,进口药品质量状态良好(都是合格的吗?),但在国家局内部抽查中,未必如此。因此,预计CFDI将根据海外药品的抽检情况,在2020年调整检验方向和重点。
4-CFDI将根据年报数据判断检查方向。
《药品管理法》,2019年12月1日实施,要求所有MAH提交年报。这些年报将客观反馈2019年所有MAH质量体系的运行情况。据预测,CFDI将进行调整