肿瘤免疫治疗无疑是目前最热门的研发方向。PD-1/PD-L1作为该领域的杰出代表,以其广泛的适应症潜力、明确的临床价值和良好的市场表现成为业界追捧的对象。然而今天,大量选手的涌入让这条赛道变得拥挤不堪,大家都在不断思考,挖掘下一个接球手。
CD47,也称为整合素相关蛋白,是一种广泛表达的跨膜糖蛋白。肿瘤可以表达CD47,与巨噬细胞表面的(SIRPa结合,向巨噬细胞发出“不要吃我”的信号,从而逃避免疫系统的攻击。因此,阻断CD47/SIRP信号有望恢复巨噬细胞对肿瘤细胞的吞噬作用。CD47在过去两年里越来越受欢迎,它已经成为I-O领域最热门的潜在赛道之一。
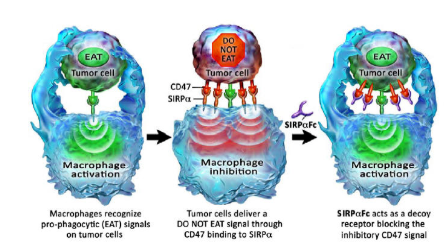
众所周知,肿瘤细胞可以通过表达PD-L1与T细胞表面的PD1结合,释放出类似“不要找我”的信号,从而逃避T细胞的监视和攻击。CD47和SIRPa的结合释放了“不要吃我”的信号,这使得肿瘤细胞能够逃脱巨噬细胞的吞噬攻击。从作用靶点来看,CD47就像PD-L1,SIRPa就像PD-1。两者的相似性不言而喻,这可能是CD47被称为下一个“PD-1”的原因之一。

来源:
迄今为止,已发现CD47在多种血液和实体肿瘤细胞中过度表达,包括骨髓瘤、非霍奇金淋巴瘤、非小细胞肺癌、急性淋巴细胞白血病、乳腺癌、头颈部鳞状细胞癌、急性髓细胞白血病等[1]。各种迹象也表明了巨大的市场潜力。能不激动人心吗?
披荆斩棘:CD47热情重燃
CD47不是一发现就火的。事实上,它已经走到了黑暗的时刻。自20世纪80年代首次被确定为人类卵巢癌的肿瘤抗原以来,CD47被发现在多种肿瘤中过度表达,其表达水平与肿瘤的预后有关[2]。1994年,Lindberg和Mawby分别对CD47蛋白进行了分离和表征,尤其是Mawby的分离过程,现在看来给了我们更多的启示[3-4]。根据文献,Mawby等人使用单克隆抗体BRIC-125通过免疫沉淀从人红细胞中分离出CD47糖蛋白。进一步的酶促糖基化显示CD47含有N-连接的寡糖,并且通过分析蛋白水解片段获得CD47的氨基酸序列。CD47的六个潜在N-糖基化位点被发现,其中五个位于IG超家族结构域,三个在红细胞中携带N-聚糖。同时,人体组织的免疫细胞化学染色也显示CD47广泛分布于间质和上皮细胞的许多部位。
后续的临床研究揭示了这一隐患。2017年底,Arch Oncology因出现严重副作用,宣布终止其CD47单克隆抗体Ti-061在欧洲的一项实体瘤临床试验;2018年,Celgene的CD47单克隆抗体CC-90002在治疗急性髓系白血病和高危骨髓增生异常综合征的I期研究中也遭遇了安全性问题。这些失败的研究也影响了有CD47项目的公司股价,如四十七、延龄草等,引起业界对CD47的反思,甚至有一段时间看不起它。
第一代CD47药物的严重临床副作用主要是血液副作用,包括红细胞和血小板减少。值得庆幸的是,以四十七和延龄草为代表的企业在面对第一代药物分子的安全性问题时,并没有完全放弃第二代CD47产品的设计和研发。相反,他们构想了多种方案来解决CD47抗体的毒副作用,包括设计新的抗体融合蛋白,减少CD47在血细胞表面的结合,从肿瘤细胞中高度选择CD47,并在一个剂量下启动激活治疗。
多亏了47公司,我们能够再次得到关注。在ASCO2018大会上,四十七所公布了Hu5F9-G4(magrolimab)联合利妥昔单抗治疗非霍奇金淋巴瘤的临床数据,并于同年11月在《新英格兰医学杂志》发表了结果。这也是CD47抗体的临床数据首次发表在顶级医学期刊上[5]。本临床研究主要评价静脉注射magrolimab初始剂量1mg/kg(初始剂量)和每周维持剂量10-30mg/kg联合利妥昔单抗的安全性和有效性,并确定II期研究剂量。结果显示,22例患者(dl bcl 15例,滤泡性淋巴瘤7例)中,治疗相关不良事件主要为1级或2级,贫血和输血相关反应最常见。Magrolimab初始和维持剂量治疗可以减少贫血(预期的靶向作用),并且剂量有限的副作用很少。在推荐的II期剂量(30mg/kg)下,Magrolimab的循环白细胞和红细胞中CD47受体的百分比约为100%。共有50%的患者表现出客观缓解,完全缓解(CR)达到14%。
2019年,四十七所在ASH2019大会上公布了新诊断的高危骨髓增生异常综合征和急性髓系白血病患者不适合诱导化疗的Magrolimab联合氮胞苷的数据。ORR分别达到92%和64%,CR(CR/CRi)达到50%以上。常见的治疗相关不良事件包括贫血(37%)、中性粒细胞减少症(26%)和血小板减少症(26%)[6]。

四十七的连续临床结果给市场注入了一剂强心针,让CD47再次升温。2020年初,吉利德以49亿美元买下四十七,彻底改变了由冷转热的目标,为CD47在2020年的表现开了个好头。FDA还授予Magrolimab突破疗法(BTD)资格,用于在2020年治疗新诊断的骨髓增生异常综合征。整个2020年,CD47相关的项目交易、企业融资、上市新闻频频刷屏:
3月3日:基列以49亿美元收购Fortyseven
7月1日:赛生制药出资1.2亿美元引进大中华区EpicentRx公司针对CD47-SIRP的小分子免疫疗法RRx-001的权益;
7月17日:ALX肿瘤上市,融资上市总额约2.9亿美元;
9月4日:天京生物与艾伯维就CD47单克隆抗体TJC4达成总价值29亿美元的全球战略合作;
9月8日:CD47的明星公司Trillium获得辉瑞2500万美元投资,股价上涨40%。
10月13日:SurfaceOncology收到GSK收购意向;
柳暗花明:CD47战火纷飞
47采用创新的实验方案,给予预激剂量,使抗CD47治疗获得积极的临床效果。四十七自然不可能是CD47研发道路上的唯一赢家。据NextPharm介绍,全球涉及CD47信号通路的项目多达72个,临床前项目45个,其中中国有24个临床前项目。可以说,中国企业的超级快速跟随能力,让CD47的竞争有了PD-1/PD-L1的味道。
目前,世界上大多数CD47项目都处于早期临床阶段。Magrolimab的预激剂量策略并不适合每一个产品,更何况四十七公司对该策略的专利保护布局,而Trillium等公司为了避免杀伤红细胞,采用了降低CD47药物与红细胞结合能力的抗体设计策略,其临床真实效果仍需验证。所以CD47赛道目前还处于战争状态,所有选手都在争先恐后的进步,占领山顶。还没有人。结合SITC2020和ASH2020会议信息,以表格形式呈现了Magrolimab之外几个有代表性的CD47项目的研发进展[7-11]。
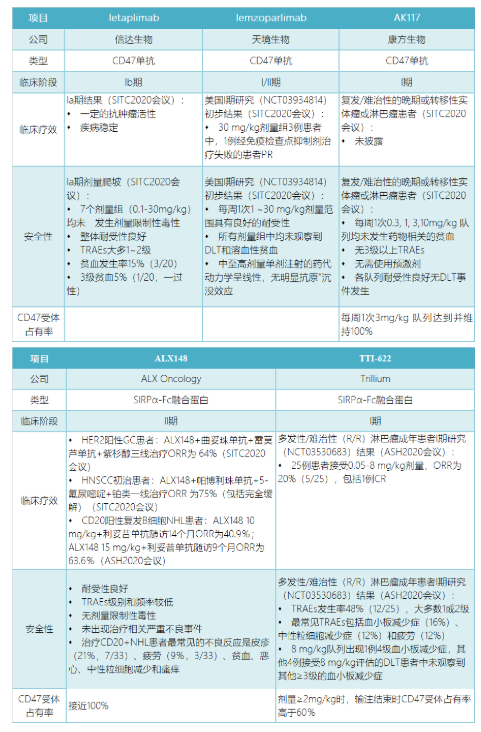
总的来说,近年来在实体肿瘤和血液肿瘤的临床研究中,一些以CD47为靶点的产品显示出了良好的临床活性,但该靶点的副作用不容忽视。尽管有创新的临床研究项目或靶向抗体设计,贫血或短暂性贫血仍会发生。虽然副作用得到了有效控制,但抗体药物能否实现疗效和安全性的有效平衡,实现CD47的临床价值,仍需进一步的临床验证。
曲径通幽:小分子调控CD47
正如小分子也是PD-1/PD-L1赛道的发展方向一样,业界也在积极尝试寻找CD47药物疗效和安全性的平衡点,小分子CD47调节药物也是一个方向。到目前为止,小分子PD-1/L1药物的研究进展最快,已经进入临床二期,而小分子CD47药物的研究已经到了三期。
2020年11月新发表的文献显示,许多靶向CD47通路的小分子候选药物正处于临床前或临床开发阶段(如下表所示)。
以CD47为靶点的小分子药物正在研发中
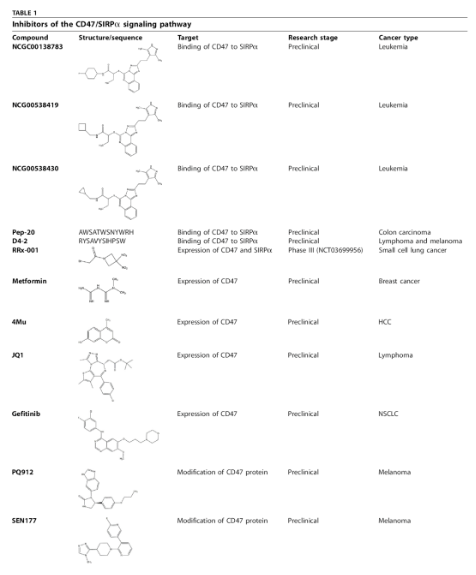
来源:参考文献[12]
从作用机理来看,这些小分子可以分为两类。一种是它们直接与CD47结合,然后阻断CD47/SIRPa信号,如NCGC00138783、pep-20、D4-2等。另一种是通过影响转录、翻译或翻译后修饰来下调CD47/SIRPa信号的表达。例如,RRX-001通过抑制癌基因在转录和翻译水平下调CD47的表达,PQ912通过抑制蛋白质生物合成后的修饰抑制蛋白质成熟,使CD47难以发挥其调节作用。
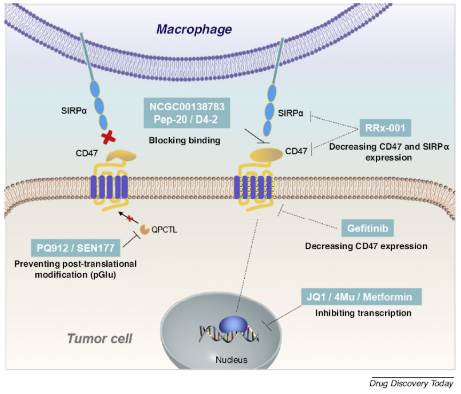
来源:参考文献[12]
与大分子药物相比,小分子CD47/SIRPa抑制剂由于半衰期短、药物暴露灵活,理论上可能在副作用控制方面更具优势。但小分子CD47/SIRPa抑制剂能否实现高选择性,即靶向肿瘤表面的CD47而不是红细胞表面的CD47,从而避免抗体药物同样的血液毒性,也是一个值得深入思考和关注的问题。
大部分小分子CD47调节剂处于临床前阶段,RRX-001是目前唯一进入临床并获得III期临床数据的药物。本文将只简单介绍这种药物。
RRx-001是一种神奇的小分子。其前身是炸药或火箭燃料的“合成中间体”,主要用于航空工业。将RRx-001带入疾病治疗领域的是化学家马克贝德纳尔斯基教授。马克贝德纳尔斯基也是一名结肠直肠癌患者。一次偶然的机会,他在犹他州的一个滑雪胜地遇到了ATKThiokol公司的另一位化学家。ATKThiokol公司是著名的国防和航空航天承包商,主要从事火箭燃料和军用炸药的设计和制造。他们一边聊天,一边在雪地里画分子结构,那些和RRx-001有关的分子结构引起了贝德纳尔斯基教授的浓厚兴趣!他敏锐的科学思维和直觉告诉他,这些结构非常独特的分子可能具有潜在的药用价值。Bednarski教授认为RRx-001分子独特的化学性质可能有助于在放射治疗中选择性地破坏癌细胞,然后他与放射肿瘤学的一位同事兼公司联合创始人SusanKnox博士开始了RRx-001的研发合作。
Mark Bednarski教授是RRx-001的坚定倡导者和推动者。正是因为他的不懈努力,RRx-001才能在包括大肠癌在内的多种癌症类型的五项临床试验中得到检验。临床研究表明,RRx-001确实可以在结肠癌、肺癌等恶性肿瘤中表现出临床获益,患者接受RRx-001治疗后,可以再次对含铂化疗进行增敏。与FDA批准的表观遗传药物(如氮胞苷和伏立诺他)相比,RRX-001仅出现轻微的副作用,主要是1级和2级注射部位疼痛,总体耐受性良好。此后,RRX-001作为一种表观遗传药物,被EpicentRX公司不断开发。
然而,最近的临床前研究证实,RRx-001可以降低CD47和PD-L1 mRNA及相关蛋白水平,增强巨噬细胞对肿瘤细胞的吞噬功能和百分比,刺激抗肿瘤免疫反应[13-14]。随后的病例研究表明,RRX-001治疗导致了类似于PD-1/L1免疫疗法的假性疾病进展和免疫细胞浸润[15-16],表明RRX-001确实在肿瘤免疫疗法中发挥了作用。
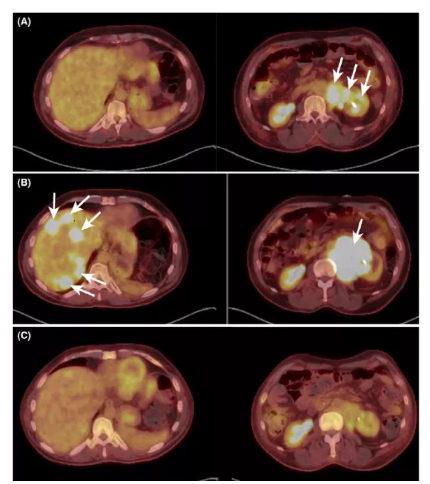
RRX-001治疗的伪进展(PET/CT扫描,A:肝左叶显示弥散背景,无离散病灶。肝右叶显示病变;b:经三剂RRx001治疗后,肝左叶出现多个离散的大病灶,肝右叶病灶增大;c:经过两个周期的铂类联合治疗,肝脏病变广泛消退,代谢反应完全,接近组织背景水平)
RRx-001在临床研究中也取得了良好的抗肿瘤效果。在小细胞肺癌三线治疗的第二阶段研究(NCT02489903)中,患者接受4mg RRx-001,每周一次,为期3周,同时给予预防药物。在ITT分析中,1名患者达到PR(3.8%),7名患者达到SD (26.9%)。在随后的ITT分析中,铂和依托泊苷的反应率包括1例CR(3.8%)和6例PR(23.1%),ORR为26.9%。中位随访时间为7.3个月,中位OS为8.6个月,估计的6个月和12个月生存率分别为66.2%和44.1%[17]。
在安全性方面,RRx-001最常见的不良事件包括输注部位反应(23%)、食欲不振(15.3%)和头痛(11.5%),这些都与药物无关。有4种3级或4级毒性,包括食欲下降、低镁血症、高血糖和肌肉骨骼疼痛。4名患者(15.3%)在RRx-001治疗期间出现疑似假肿瘤进展,伴有疼痛和肿瘤扫描增大,但使用RRx-001治疗后,症状改善,肿瘤稳定或缩小[17]。
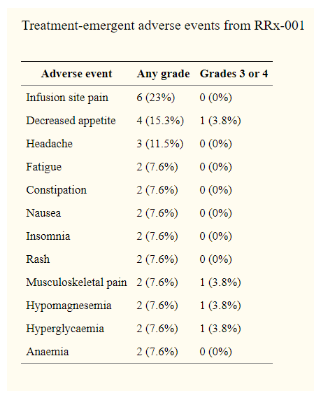
此外,它还显示在治疗三线结肠癌中,中位OS获益(8.6比4.7个月)比瑞格非尼更长。在安全性方面,在剂量递增研究(NCT01359982)中,RRx-001的最高剂量(83 mg/m2)没有到达DLT。
其实像RRx-001这种脱靶免疫调节并不是孤例。例如,PARP抑制剂的作用机制和抗肿瘤效果已经相当清楚。然而,最近的研究表明,PARP抑制剂的疗效还取决于肿瘤中STING途径激活诱导的免疫反应[18-19]。
结语
与抗体药物相比,小分子药物有很多优点。首先是成本优势。如果能达到同样的治疗效果,对于患者可及性的意义自然不言而喻。其次,小分子药物由于给药方式多样,比抗体药物有更好的接受度和依从性。此外,小分子可以靶向细胞或肿瘤。对于作用机制不同的药物,有些药物可以调节肿瘤的微环境,甚至有希望将“冷”肿瘤变成“热”肿瘤。
在解决了靶向毒副作用后,track CD47已在多种实体肿瘤和血液肿瘤中显示出积极的临床价值。从药物类型来看,抗体、融合蛋白等大分子药物仍是该赛道的主流类型。PD-1/L1抗体的激烈竞争是否会在CD47赛道重现还是未知数,但小分子CD47调节因子确实是目前竞争格局中的一个变量。在研发小分子CD47药物的道路上,除了高选择性分子和瘤内给药的技术和策略,以RRx-001为代表的下调CD47/SIRPa也是一个值得尝试的方向。
参考数据
[1]癌症免疫逃避中的CD47SIRPa途径和潜在的治疗意义。免疫学最新观点2012,24:225232
[2]CD47-信号调节蛋白(SIRPa)相互作用是人类类实体瘤的治疗靶点。PNAS 2012;109:17:6662-6667
[3]Rh相关抗原CD47是信号转导整合素相关蛋白。《生物化学杂志》(1994),269(3),1567-70
[4]CD47糖蛋白的分离和表征:与整合素相关蛋白(IAP)和卵巢肿瘤标记物OA3相同的跨膜蛋白.《生物化学杂志》( 1994年),第304期(第2卷)第525-30页
[5]非霍奇金淋巴瘤中Hu5F9-G4和利妥昔单抗对CD47的阻断。英国医学博士。2018年11月1日;379(18):1711-1721
[6]同类首个抗CD47抗体Magrolimab (5F9)联合阿扎胞苷对MDS和AML患者有效:正在进行的1b期(2019) 134(增补_1): 569。
[7]信达生物官网
[8] Alxonology官方网站
[9]天京生物官网
[10]康方生物网站
[11]延龄草网站
[12]针对CD47的小分子抑制剂的开发100 . drug discov今日(2020年),
[13] MYC通过CD47和PD-L1调节抗肿瘤免疫反应。科学。2016年四月8日;352(6282): 227231
[14] RRx-001通过下调癌细胞上的CD47和单核细胞/巨噬细胞上的SIRP来充当双重小分子检查点抑制剂。转化肿瘤学(2019) 12,626632
[15]用RRx‐001和重新引入的铂双重治疗后,转移性去势抵抗性前列腺神经内分泌癌的完全代谢反应临床案例代表2018;6:24782481
[16]在接受表观遗传剂RRx-001治疗的系列活检神经内分泌患者中的免疫反应性和假性进展或肿瘤恶化。案件代表oncol .2016年1-4月;9(1): 164170.
[17] RRx-001继之以铂加依托泊苷用于先前治疗的小细胞肺癌患者。癌症。2019年七月30日;121(3):211217.
[18]在小细胞肺癌中,靶向脱氧核糖核酸损伤反应通过讽刺介导的T细胞活化促进抗肿瘤免疫。癌症发现。2019,9(5):646-661
[19]在乳腺癌缺陷型三阴性乳腺癌模型中,PARP抑制剂的疗效取决于通过肿瘤内讽刺途径激活的CD8 T细胞募集。癌症发现。2019 ,9(6):722-737
