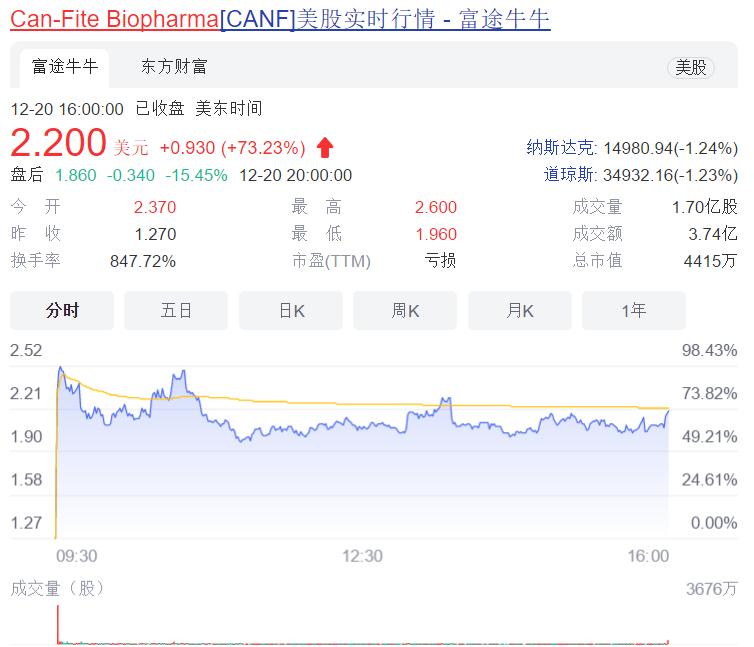
12月20日, Can-Fite宣布,在Namodenoson治疗肝细胞癌 (HCC)的II期研究的开放标签扩展试验部分,接受治疗的最后一名患者获得了完全缓解 (CR) ,这意味着这名患者的所有癌症病灶全部清除。
在接受namodenson治疗后,患者已经存活了5年,在此期间治疗的临床益处包括腹水消失、肝功能正常以及腹腔内散布性癌症消失,所有癌症病灶完全清除。受此消息影响,截至收盘,该公司股价大涨73%。
Namodenoson是一种高选择性、口服小分子A3腺苷受体(A3AR)激动剂,作用机制是通过NF-B和Wnt信号转导途径的去调节介导,导致肿瘤细胞凋亡;通过降低信号蛋白磷酸肌醇-3-磷酸(PI3K)的表达水平赋予三种下游信号转导途径,即Wnt、NF-B和-SMA,共同控制肝脏炎症、纤维化和脂肪变性。A3AR在患病细胞中高表达,而在正常细胞中低表达。Namodenoson目前被开发用于肝细胞癌二线治疗及非酒精性脂肪性肝病/非酒精性脂肪性肝炎。
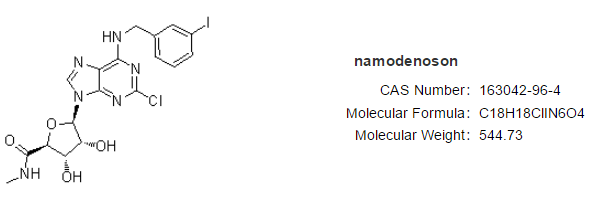
Can-Fite预计将在2022年第一季度开始Namodenoson的关键III期试验患者招募,用于治疗患有潜在 Child Pugh B7 (CPB7) 肝硬化的晚期 HCC 患者,以支持新药申请 (NDA) 的提交和批准。美国FDA和欧洲药品管理局 (EMA) 均同意471名患者的试验方案设计。Namodenoson已在美国和欧洲获得 治疗HCC的孤儿药资格认定,在美国具有快速通道资格。目前已获批在以色列通过同情使用计划治疗肝癌患者。
值得注意的是,2018年8月,康哲药业以200万美元的预付款、合计7250万美元的里程碑付款以及净销售额两位数的特许权使用费与Can-Fite达成授权合作,获得在大中华区开发Namodenoson和Piclidenoson(另一款A3AR激动剂,银屑病)的权益。
注:原文有删减