编译丨newborn
今年以来,美国FDA共批准了45款创新药物,去年同期为44款、去年全年为53款。在11月份,FDA批准了3款(Livtencity、Voxzogo、Besremi),其中:
武田制药抗病毒药物Livtencity是第一个用于移植受者治疗难治性CMV感染的药物;
BioMarin公司C型利钠肽(CNP)类似物Voxzogo是第一个治疗儿童软骨发育不全症的药物;
台湾药华医药公司创新单PEG化长效干扰素Besremi是第一个专门治疗真性红细胞增多症(PV)的干扰素产品。
进入12月份,有多款药物将迎来FDA的重要审查决定。以下对这些药物进行的简单汇总:
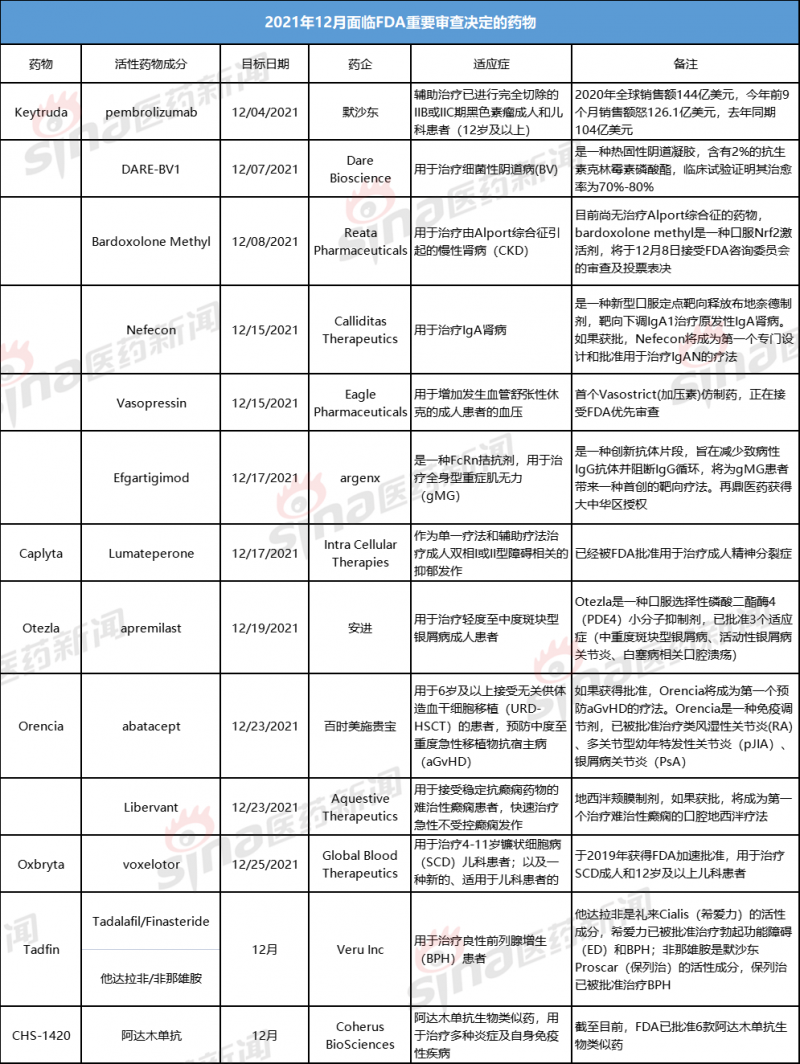
其中几款重磅药物如下:
企业:默沙东
药物:Keytruda
预计获批时间:2021年12月4日
适应症:辅助治疗已进行完全切除的IIB或IIC期黑色素瘤成人和儿科患者(12岁及以上)
美国FDA在今年8月初受理了默沙东Keytruda的补充生物制品许可申请(sBLA)。目前FDA已授予该sBLA优先审查,并指定《处方药用户收费法》(PDUFA)目标日期为2021年12月4日。
据悉,该sBLA主要是基于3期KEYNOTE-716试验的数据,该项临床试验KEYNOTE-716的数据已于本月早些时候在黑色素瘤研究学会(SMR)2021年大会上发布。
KEYNOTE-716是一项多中心、随机、双盲3期临床试验,正在比较Keytruda与安慰剂辅助治疗IIB或IIC期黑色素瘤完全切除后的成人和儿科(12岁及以上)患者的疗效和安全性。该试验的主要终点是无复发生存期(RFS)。
在方案规定的第二次中期分析(IA2)中,与安慰剂相比,Keytruda辅助治疗持续显示RFS有临床意义的改善,疾病复发或死亡风险降低39%(HR=0.61[95%CI:0.45-0.82])。KEYNOTE-716试验在第一次中期分析中已达到了RFS主要终点(HR=0.65[95%CI:0.46-0.92];p=0.00658),因此,在IA2未进行统计学检验。没有观察到新的安全信号。
IA2时,接受Keytruda治疗的患者中有14.8%(n=72/487)复发或死亡,而接受安慰剂治疗的患者中有23.5%(n=115/489)。在本次分析时,2组的RFS中值均未达到。安慰剂组(12.3%[n=60/489])患者的远端复发率是Keytruda组(6.4%[n=31/487])患者的2倍。
在IA2时,Keytruda的安全特性与之前的报告一致。Keytruda治疗组、安慰剂组分别有82.8%(n=400/483)、63.4%(n=308/486)发生治疗相关不良事件,分别有17.0%(n=82/483)、4.3%(n=21/486)的患者出现3-4级不良事件,分别有10.1%(n=49/483)和1.2%(n=6/486)的患者发生3-4级免疫介导的不良事件和输液反应。
企业:安进
药物:Otezla(apremilast,阿普米司特)
预计获批时间:2021年12月19日
适应症:治疗轻度至中度斑块型银屑病成人患者
Otezla是一种口服小分子磷酸二酯酶4(PDE4)抑制剂,对环磷酸腺苷(cAMP)具有特异性,它可以通过抑制PDE4促使细胞内环磷酸腺苷(cAMP)含量升高,从而增加抗炎细胞因子,并下调炎症反应。2019年8月,安进以134亿美元的价格从新基和BMS手中收购。该药物持续保持在银屑病一线市场的领先地位。去年,安进在全球的销售额接近22亿美元。据估计,Otezla的销售收入到2023年或将超过30亿美元。
2014年,Otezla在美国获批上市,目前在美国已获批三个适应症,包括成年活动性银屑病关节炎(PsA)、中度至重度斑块型银屑病以及贝赫切特综合征(Behcet)相关的口腔溃疡。今年8月16日,安进Otezla(apremilast,阿普米司特片)在中国获批上市,用于银屑病。
今年9月,安进在一项关于其与Sandoz和Zydus针对重磅炸弹银屑病治疗药物Otezla的专利纠纷中胜诉。美国新泽西州特伦顿地区法官Michael Shipp表示,Sandoz和Zydus两家公司提议的仿制药均侵犯了安进持有的三项专利。法院做出了对安进有利的判决,使得该药物在COM专利(美国专利号7,427,638)于2028年2月到期前,阻止Sandoz和Zydus制造、使用、销售、提供销售或进口任何版本的Otezla仿制药物。
百时美施贵宝的TYK2抑制剂deucvacitinib为Otezla的竞争药物,去年11月,在一项针对中度至重度斑块型银屑病患者的3期POETYK PSO-1关键临床试验中,百时美施贵宝TYK2抑制剂deucravacitinib的疗效超过了Otezla。研究数据表明,与Otezla相比,患者在第16周经deucravacitinib 治疗后达到PASI 75和sPGA 0/1的患者比例优于Otezla。在此项研究中,deucravacitinib的总体安全性结果与此前公布的II期研究结果一致。
企业:百时美施贵宝
药物名称:Orencia(abatacept,阿巴西普)
预计获批时间:12月23日
适应症:用于6岁及以上接受无关供体造血干细胞移植(URD-HSCT)的患者,预防中度至重度急性移植物抗宿主病(aGvHD)
阿巴西普是全球类风湿关节炎领域第一个被批准的T细胞选择性共刺激免疫调节剂,通过与抗原递呈细胞上的CD80和CD86结合进而阻断2者与T细胞上的CD28的相互作用,抑制T细胞的激活。激活的T-细胞被认为与多种炎症性疾病相关,包括类风湿性关节炎(RA)、银屑病关节炎(PsA)、幼年特发性关节炎(JIA)等。T-细胞完全激活至少需要得到来自抗原递呈细胞的2种信号,其中T细胞上的CD28与抗原递呈细胞上CD80或CD86的相互作用是共刺激信号传导的关键步骤。
在美国,该药自2005年上市后已获批3个适应症:(1)用于治疗中度至重度活动性类风湿性关节炎(RA)成人患者;(2)用于治疗2岁及以上中度至重度活动性多关节型幼年特发性关节炎(pJIA)患者;(3)用于治疗活动性银屑病关节炎(PsA)成人患者。用药方面,不建议将Orencia与其他有效的免疫抑制剂同时使用,如:生物类疾病修饰抗风湿药物(bDMARD)、JAK抑制剂。
在中国大陆,阿巴西普注射液由先声药业与百时美施贵宝合作开发。2020年8月9日,阿巴西普举办上市会,标志着该产品在中国大陆地区正式进入商业流通环节。
参考来源:Biotech Stocks Facing FDA Decision In December 2021