2020版《中国药典》曾经面世,该药典虽收载了0261制药用水公则,但正在制水工艺、进程节制、可操作性和出产举措措施等方面皆另有很大的晋升空间。近几年国际药典的更新跟技巧的先进十分快,制药用水波及药品出产的各个环节,是保障药品平安的紧张因素。为知足以后中国制药行业开展的需要,美满制药用水工艺和进程节制,修订美满制药用水公则也是行业开展的须要。
我国实行《药品出产质量经管范例》(2010年修订)已十余年工夫,参考以后国际药典跟相关国际组织对制药用水的技巧要求,联合以基于危险的准则跟我国制药用水和设备的整体情况,进一步美满以后药典收载的0261制药用水公则,增强制药用水的源头跟进程节制要求,促进进步前辈、节能、环保的工艺举措措施的使用,进步制药用水的质量对进一步保证药品的安全性意思庞大。
制药用水简介
制药用水平常指制药工艺进程中用到的各类质量标准的火。制药用水是制药出产进程的紧张质料,介入了全部生产工艺进程,包罗质料出产、离散纯化、废品制备、洗涤进程、荡涤进程跟消毒进程等。是以,正在制药出产进程中,制药用水体系是至关重要的组成部分。
制药用蒸汽体系是干冷灭菌的一种介质,次要使用于打针用水体系、干冷灭菌柜、生物反应器、配液罐、管路体系、过滤器等紧张设备与体系的灭菌。罕见的制药用蒸汽体系次要为杂蒸汽体系,杂蒸汽的冷凝水间接与设备或物品概况打仗,或许打仗到用以剖析物品性子的物料,杂蒸汽冷凝后的水质需知足打针用水质量标准,是以,制药用蒸汽体系也是医药行业无菌生产工艺进程中一个十分紧张的组成部分。
制药用水跟制药用蒸汽的质量从药品出产质量经管范例(GMP)跟药典的角度来看十分紧张,从优越的工程经管范例(GEP)跟经济的角度来看也一样紧张,制药出产企业必需证实其所利用的制药用水体系与制药用蒸汽体系能始终如一天供给到达质量标准的制药用水与制药用蒸汽。
平常环境下,制药行业将制药用水体系与制药用蒸汽体系统称为制药用水体系,简称火体系。制备制药用水的实质是削减或祛除潜伏的污染源,欧盟跟WHO将制药用水中的杂质列为潜伏杂质起源之一,基于这个问题的思量,本书提出若何停止制药用水制备、贮存与分派体系的计划并确保传染危险失掉节制。
1.1 制药用水的分类
对制药用水的界说跟用途,平常以药典为准,列国药典对制药用水平常有分歧的界说、分歧的用途划定。
从利用角度分类,制药用水次要分为散装火与包装火两大类。散装火特指制药出产企业按相关生产工艺克己的制药用水,例如,中国药典承认的散装火包罗纯化火跟打针用水;欧盟药典承认的散装火包罗散装纯化火、草药提取用水跟打针用水;美国药典承认的散装火包罗散装纯化火、血液透析用水跟打针用水等。包装火也称废品火,特指按制药工艺出产的包装废品火,例如,中国药典收录了灭菌打针用水;欧盟药典收录了包装纯化火跟灭菌打针用水等;美国药典收录了抑菌打针用水、灭菌吸入用水、灭菌打针用水、灭菌冲刷用水跟灭菌纯化水等多种产品火(表1)。
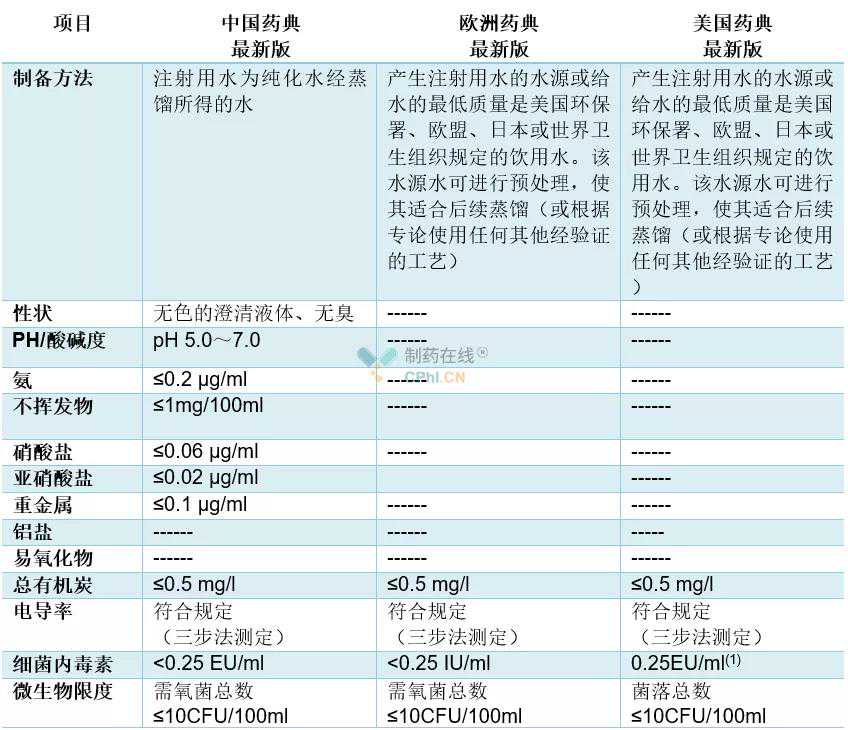
表3散装打针用水的质量对照表
备注:(1)商业用途的散装打针用水。
1.4 中国药典与制药用水
中国药典(Chinese Pharmacopoeia,CP)的最新版本为2020年12月30驲行将正式实行的2020版《中国药典》。与2015 年版《中国药典》一样,2020年版《中国药典》由四部构成,一部为中药,二部为化学药品,三部为生物制品,四部为公则跟辅料尺度。2020版《中国药典》新增319种,修订3177种,不再收载10种,种类调剂归并4种,共收载种类5911种。一部中药收载2711种,此中新增117种、修订452种。二部化学药收载2712种,此中新增117种、修订2387种。三部生物制品收载153种,此中新增20种、修订126种;新增生物制品公则2个、总论4个。四部收载通用技巧要求361个,此中制剂公则38个(修订35个)、检测方式及其他公则281个(新增35个、修订51个)、指点准则42个(新增12个、修订12个);药用辅料收载335种,此中新增65种、修订212种。
中国药典中所收载的制药用水包罗纯化火、打针用水及灭菌打针用水,与2015版《中国药典》比拟,2020版《中国药典》正在制药用水相关划定上不变更。
2020版《中国药典》纯化火质量应合乎二部中对于纯化火的相关划定,纯化水可作为配制平凡药物制剂用的溶剂或试验用水;可作为中药注射剂、滴眼剂等灭菌制剂所用药材的提取溶剂;口服、外用制剂配制用溶剂或稀释剂;非灭菌制剂用用具的精洗用水;也可用作为非灭菌制剂所用药材的提取溶剂。纯化火不得用于注射剂的配制与浓缩。纯化水有多种制备方式,应严厉监测各出产环节、防备微生物传染、确保利用面的水质。2020版《中国药典》对于纯化火的质量标准参见以下内容:
纯化火
Chunhuashui
Purified Water
H2O 18.02
本品为饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方式制得的制药用水,没有露任何添加剂。
【性状】 本品为无色的廓清液体;无臭。
【检査】 酸碱度 与本品10ml,减甲基白唆使液2滴,不得隐白色;另取10ml,减溴麝香草酚蓝唆使液5滴,不得隐蓝色。
硝酸盐 与本品5ml置试管中,于冰浴中冷却,减10%氯化钾溶液0.4ml与0.1%两苯胺硫酸溶液0.1ml,摇匀,徐徐滴加硫酸5ml,摇匀,将试管于50℃水浴中安排15分钟,溶液发生的蓝色与尺度硝酸盐溶液[与硝酸钾0.163g,加水消融并浓缩至100ml,摇匀,周详量取1ml,加水浓缩成100ml,再周详量取10ml,加水浓缩成100ml,摇匀,即得(每1ml相当于1gNO3)]0.3ml,加无硝酸盐的火4.7ml,用统一方式处置惩罚后的颜色比力,不得更深(0.000 006%)。
亚硝酸盐 与本品10ml,置纳氏管中,减对氨基苯磺酰胺的稀盐酸溶液(1100)1ml与盐酸萘乙二胺溶液(0.1100)1ml,发生的粉红色,与尺度亚硝酸盐溶液[取亚硝酸钾0.750g(按干燥品计较),加水消融,浓缩至100ml,摇匀,周详量取1ml,加水浓缩成100ml,再周详量取1ml,加水浓缩成50ml,摇匀,即得(每1ml相当于1gNO2)]0.2ml,加无亚硝酸盐的火9.8ml,用统一方式处置惩罚后的颜色比力,不得更深(0. 000 002% )。
氨 与本品50ml,减碱性碘 化 汞钾试液2ml,安排15分钟;如显色,与氯化铵溶液(与氯化铵31.5mg,加无氨水适量使消融并浓缩成1000ml)1.5ml,加无氨水48ml与碱性碘 化 汞钾试液2ml制成的对比液比力,不得更深(0.000 03%)。
电导率 应符合规定(公则0681)。
总无机碳 不得过0.50mg/L(公则0682)。
易氧化物 与本品100ml,减稀硫酸10ml,煮沸后,减高锰酸钾滴定液(0.02mol/L)0.10ml,再煮沸10分钟,粉红色不得完整消失。
以上总无机碳和易氧化物两项可选做一项。
没有挥发物 与本品100ml,置105℃恒重的蒸发皿中,正在水浴上蒸干,并正在105℃干燥至恒重,遗留残渣不得过1mg。
重金属 与本品100ml,加水19ml,蒸发至20ml,放冷,减醋酸盐缓冲液2ml与火适量使成25ml,加硫代乙酰胺试液2ml,摇匀,安排2分钟,与尺度铅溶液1.0ml加水19ml用统一方式处置惩罚后的颜色比力,不得更深(0.000 01%)。
微生物限度 与本品很多于1ml,经薄膜过滤法处置惩罚,采取R2A琼脂培养基,30〜35 ℃培育很多于5天,依法检査(公则1105),1ml供试品中需氧菌总数不得过100cfu。
R2A琼脂培养基处方及制备
酵母浸出粉 0.5g
卵白胨 0.5g
酪蛋白水解物 0.5g
葡萄糖 0.5g
可溶性淀粉 0.5g
磷酸氢二钾 0.3g
无水硫酸镁 0.024g
丙酮酸钠 0.3g
琼脂 15g
纯化火 1000ml
除葡萄糖、琼脂中,与上述身分,混淆,微温消融,调节pH值使加热后正在25 ℃的pH值为7.20.2,减人琼脂,加热熔解后,再加人葡萄糖,摇匀,分装,灭菌。
R2A琼脂培养基适用性搜检实验 照非无菌产物微生物限度检査:微生物计数法(公则1105)中"计数培养基适用性搜检"的胰酪大豆胨琼脂培养基的适用性检査方式停止,实验菌株为铜绿假单胞菌跟枯草芽孢杆菌。应符合规定。
【种别】 溶剂、稀释剂。
【贮藏】 密闭保留。
2020版《中国药典》打针用水质量应合乎二部中对于打针用水的相关划定,打针用水必需正在抑止细菌内毒素发生的前提下制备、贮存与分派。打针用水可作为配制注射剂、滴眼剂等无菌剂型的溶剂或稀释剂,和容器的精洗。为保障打针用水的质量,应削减本水中的细菌内毒素,监控蒸馏法制备打针用水的各出产环节并防备微生物的传染,应按期荡涤与消毒打针用水体系。打针用水的贮存方法应颠末验证,确保水质合乎质量要求,例如,推举用户正在70℃以上保温轮回。2020版《中国药典》对于打针用水的质量标准参见以下内容:
打针用水
Zhusheyong Shui
Water for Injection
本品为纯化火经蒸馏所得的火。
【性状】 本品为无色的澄明液体;无臭。
【检査】 pH值 与本品100ml,减饱和氯化钾溶液0.3ml,依法测定(公则0631),pH值应为5.0〜7.0。
氨 与本品50ml,照纯化水项下的方式检査,但对比用氯化铵溶液改为1.0ml,应符合规定(0.000 02% ) 。
硝酸盐与亚硝酸盐、电导率、总无机碳、没有挥发物与重金属 照纯化水项下的方式搜检,应符合规定。
细菌内毒素 与本品,依法搜检(公则1143),每1ml中含内毒素的量应小于0.25EU。
微生物限度 与本品很多于100ml,经薄膜过滤法处置惩罚,采取R2A琼脂培养基,30〜35 ℃培育很多于5天,依法检査(公则1105),100ml供试品中需氧菌总数不得过10cfu。
R2A琼脂培养基处方、制备及适用性搜检实验照纯化水项下的方式搜检,应符合规定。
【种别】 溶剂。
【贮藏】 密闭保留。
2020版《中国药典》灭菌打针用水质量应合乎二部中对于灭菌打针用水的相关划定,中国药典灭菌打针用水没有露任何添加剂,次要用于注射用灭菌粉末的溶剂或注射剂的稀释剂,其质量符合中国药典对于灭菌打针用水的相关划定。灭菌打针用水灌装规格应顺应临床须要,制止年夜规格、屡次利用形成的传染。2020版《中国药典》对于灭菌打针用水的质量标准参见以下内容:
灭菌打针用水
Miejun Zhusheyong Shui
Sterile Water for Injection
本品为打针用水照注射剂生产工艺制备所得。
【性状】 本品为无色的澄明液体;无臭。
【检査】 pH值 与本品100ml,减饱和氯化钾溶液0.3ml,依法测定(公则0631),pH值应为5.0〜7.0。
氯化物、硫酸盐与钙盐 与本品,分置三支试管中,每管各50ml,第一管中加硝酸5滴与硝酸银试液1ml,第二管中加氯化钡试液5ml,第三管中加草酸铵试液2ml,均不得产生混浊。
二氧化碳 与本品25ml,置50ml具塞量筒中,减氢氧化钙试液25ml,密塞振摇,安排,1小时内不得产生混浊。
易氧化物 与本品100ml,减稀硫酸10ml,煮沸后,减高锰酸钾滴定液(0.02mol/L)0.10ml,再煮沸10分钟,粉红色不得完整消失。
硝酸盐与亚硝酸盐、氨、电导率、没有挥发物、重金属与细菌内毒素 照打针用水项下的方式搜检,应符合规定。
其他应合乎注射剂项下有关的各项规定(公则0102)。
【种别】 溶剂、冲刷剂。
【规格】 (1)1ml (2)2ml (3)3ml (4)5ml (5)10ml (6)20ml (7)50ml (8)500ml (9)1000ml (10)3000ml(冲刷用)
【贮藏】 密闭保留。
1.5 中国GMP与制药用水
《中国GMP》(2010版)正在"第五章 设备"的第六节中对制药用水有明白的划定,详细以下:
第九十六条制药用水应该得当其用途,并合乎《中华人民共和国药典》的质量标准及相关要求。制药用水至少应该采取饮用水。
第九十七条火处置惩罚设备及其运送体系的计划、装置、运转跟保护应该确保制药用水到达设定的质量标准。火处置惩罚设备的运转不得超越其计划才能。
第九十八条纯化火、打针用水储罐跟运送管道所用资料应该无毒、耐腐蚀;储罐的通气口应该装置没有脱落纤维的疏水性除菌滤器;管道的计划跟装置应该制止死角、盲管。
第九十九条纯化火、打针用水的制备、贮存跟分派应该可能防备微生物的繁殖。纯化水可采取轮回,打针用水可采取70℃以上保温轮回。
第一百条应该对制药用水及原水的水质停止按期监测,并有响应的纪录。
第一百整一条应该依照操作规程对纯化火、打针用水管道停止荡涤消毒,并有相关纪录。发明制药用水微生物传染到达警惕限度、纠偏限度时应该依照操作规程处置惩罚。
正在《中国GMP》(2010版)"附录一 无菌药品"中,对制药用水细菌内毒素的监测要求以下:
第五十条 需要时,应该按期监测制药用水的细菌内毒素,保留监测成果及所采用纠偏步伐的相关纪录。
与《中国GMP》(1998版)比拟,《中国GMP》(2010版)对制药用水的要求加倍濒临欧盟GMP对制药用水的要求,新版药典采取更迷信的方式去检测水质质量,引入电导跟TOC等外洋风行的检测目标。同时,《中国GMP》(2010版)采取"进程节制"剖析理念,强调纯化火、打针用水的制备、贮存跟分派应该可能防备微生物的繁殖,勾销了对制药用水运转温度的强迫约束;此外,《中国GMP》(2010版)发起采取便于趋向剖析的方式保留数据,如制药用水的电导、TOC、温度跟微生物监测数据等,强调自动化节制与纪录等方式的重要性,强调文件系统跟全部体系的可追溯性。与此同时,国家标准《GB 50913-2013 医药工艺用水体系设计规范》与《火体系GMP实行指南(2010版)》等行业标准也为中国制药用水体系的计划、制作、调试、验证与保护供给了技巧参考与律例发起。