文|邢骁
3月24日,FDA正式宣布PD-L1抗体Bavencio(Avelumab)上市。这种药物是德国默克公司和辉瑞公司联合开发的免疫治疗新药,将用于治疗12岁以上的成人和儿童转移性默克尔细胞癌(MCC),包括那些以前没有接受过化疗的患者。
这条新闻流行了好几天,主要有两个原因:
1.用这种药物治疗的MCC是一种罕见的皮肤癌。在获得FDA授予的突破性药物资格后,Bavencio获得了基于应答率和应答持续时间数据的加速评估,成为首个获准用于MCC的PD-L1单克隆抗体。
2.在此之前,PD-1/PD-L1药物一直保持着三足鼎立的局面。分别是百时美施贵宝(BMS)的Opdivo(Nivolumab)、默沙东(MSD)的Keytruda(Pembrolizumab)和罗氏的Tecentriq(Atezolizumab),其中前两个是PD-1。作为第四个获批的PD-1/PD-L1药物,Bavencio(Avelumab)打破了这一局面。
根据Research and Markets今年1月发布的报告,2016年PD-1/PD-L1抑制剂的全球市场份额达到49.26亿美元,到2025年将以23.4%的复合年增长率增长。根据当时报告中给出的数据,PD-1/PD-L1抑制剂的产品管道中有47种药物和245项活跃的临床研究。其中,管道中74%的药物分子为PD-1抑制剂,其余为PD-L1抑制剂。
拥有黑色素瘤和非小细胞肺癌等六大适应症的Opdivo是2016年全球最畅销的药物,销售额接近40亿美元,而Tecentriq被认为正在高速发展,有望在2024年前超过Keytruda。
PD-1/PD-L1类药物在中国的临床试验情况
1、Keytruda(Pembrolizumab)
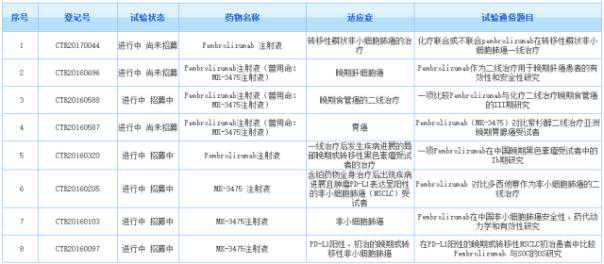
2、Tecentriq(阿替唑单抗)

3、奥普迪沃(Nivolumab)

国内外主要玩家及国内产品临床情况
自问世以来,PD-1/PD-L1药物已成为免疫疗法中最具吸引力的肿瘤免疫疗法之一。肥沃的市场也吸引了各大医药巨头疯狂抢占市场。目前,除了默沙东、BMS和罗氏是全球市场的主要参与者外,AZ、辉瑞、诺华、Regeneron、小野制药、默沙东等。也造成了激烈的市场竞争。
除了批准默克和辉瑞的Bavencio(Avelumab)用于MCC外,其用于在含铂化疗期间或之后治疗局部晚期或转移性尿路上皮癌(mUC)的生物制品许可(BLA)申请也已被FDA正式接受。
PD-1/PD-L1领域也有不少国内企业,如君实生物、恒瑞医药、百济神州、信达生物、嘉禾生物、宇恒药业、康宁杰瑞/思思迪、济世药业等
1、君实生物 
君生物是一家专注于治疗性抗体研发的研发型高科技公司,专注于创新性单克隆抗体药物和其他治疗性蛋白药物的R&D和产业化。2015年在新三板挂牌。
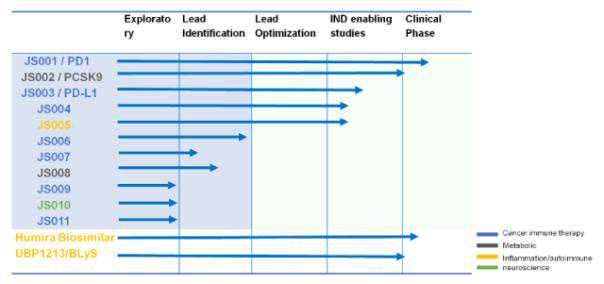
君生物制品管道中的JS001和JS003为PD-1/PD-L1药物。JS001也是海外应用项目,是中央财政470万元的重大专项。如果顺利的话,估计2020年上市。
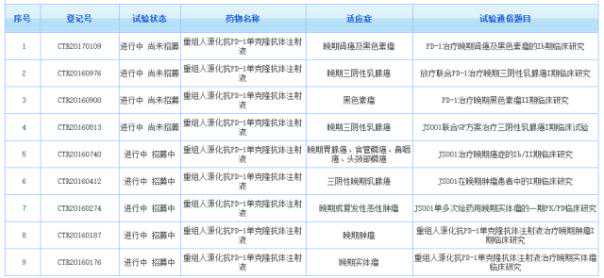
2、恒瑞医药 
恒瑞是中国最大的抗肿瘤药物研发和生产基地,也是中国最具创新力的大型制药企业之一,于2000年在上海证券交易所上市。
目前公司的PD-1抗体(SHR-1210)已进入临床II期,而PD-L1抗体(SHR-1316注射液)在国内仍处于等待阶段。
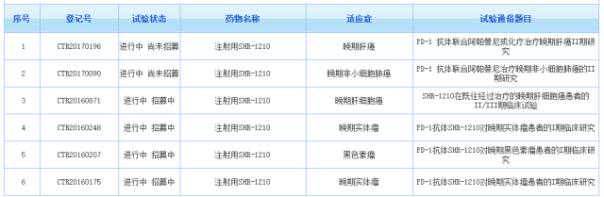
3.百济神州

百济神州致力于成为分子靶向和免疫抗肿瘤药物研发的创新领导者。2016年4月在美国纳斯达克上市。其PD-1单克隆抗体BGB-A317不同于目前批准的PD-1抗体。通过生物工程技术,解除了与Fcg受体I的结合能力,通过抑制PD-1,解除免疫系统的激活屏障,恢复了T细胞的肿瘤杀伤能力。

4.康宁杰里/西迪

杰瑞和西迪合作研发的PD-L1单克隆抗体KN035于2016年11月通过FDA评审,获准在美国开展临床研究,成为美国首个创新抗体药物,由中国R&D企业自主研发制造。


除上述企业的产品已进入临床阶段外,基石药业的重组PD-L1单克隆抗体WBP3155也已被CFDA正式接受。此外,国内还有东城制药、精华制药、东方百泰、傅宏翰林、安科生物等。还布置了PD-1/PD-L1油田。
全球程序性死亡-1 (PD-1)程序性死亡配体-1 (PD-L1)抑制剂管道分析,市场规模,份额,发展,增长和需求预测至2025年
临床试验注册和信息公示平台
官方网站中的主要公司