文|史圣
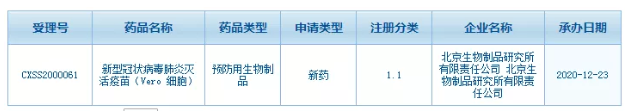
据最新消息,据国家美国食品药品监督管理局消息,12月23日,北京生物制品研究所新冠肺炎灭活疫苗(Vero cell)上市申请获食品药品监督管理局受理。该数据在CDE官网闪现,多家媒体争相报道,并一度登上热搜,国药集团股价涨幅超过10%。但是从12月24日到现在,边肖多次查询,也没有查到这个上市申请的受理信息。
12月24日上午截图
截稿时间截图
2月1日,国药中国生物作为牵头单位,获得科技部“公共安全风险防控与应急技术装备”国家重点R&D计划重点专项灭活疫苗项目应急批复。
4月12日,武汉生物制品研究所研制的新冠肺炎灭活疫苗获得临床试验批文,同步开展国内I/II期临床试验。
4月27日,北京生物制品研究所研制的新冠肺炎灭活疫苗再次获批临床试验,为新冠肺炎疫苗研发再添双保险。
10月16日,国际医学杂志《柳叶刀》发表了国药集团中国生物制品研究所与中国疾病预防控制中心联合研制的新冠肺炎灭活疫苗I/II期临床试验结果。结果显示,共有640名受试者参加了I/II期临床试验,结果显示疫苗能有效诱导中和抗体,且无严重不良反应。
11月25日,中国国药控股集团有限公司副总经理石表示,已向国家提交疫苗上市申请。
12月9日,国药中生新冠肺炎灭活疫苗在阿联酋获批上市。阿联酋通讯社称,阿联酋卫生预防部和阿布扎比卫生部已经审核了国药提交的三期临床试验数据。这对来自125个不同民族的约31000名志愿者的临床实验表明,中国生产的新冠肺炎灭活疫苗对病毒感染的有效率为86%,中和抗体转化率为99%。它可以预防100%的中度和重度新冠肺炎病例。然而,三期临床试验的中期数据尚未在全球公布。
12月24日,CDE官网显示,京生物所有限公司新冠肺炎灭活疫苗(Vero细胞)上市申请已于12月23日被食品药品监督管理局受理;
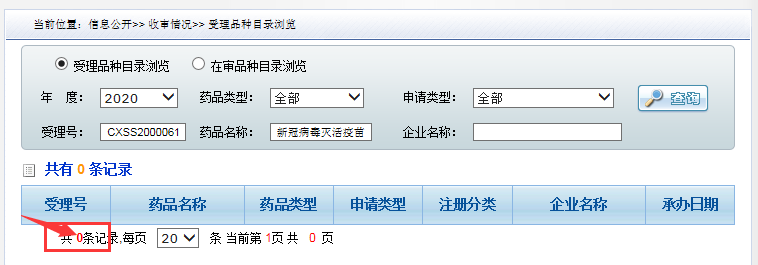
12月24日,再次查询CDE官网,庭审的消息没有了。
12月25日,再次查询CDE官网,依然没有开庭的消息。
据悉,国药中生新冠肺炎灭活疫苗是目前国内R&D进展最快的新冠肺炎疫苗。国药中生表示,北京生物制品研究所和武汉生物制品研究所两个生产车间已经建成,明年产能有望达到10亿剂以上,可确保疫苗安全充足供应。
根据江苏省药品(医用耗材)阳光采购与综合监管平台发布的《省公共资源交易中心关于公布新型冠状病毒疫苗采购结果的通知》,北京科兴中威生物科技有限公司、北京生物制品研究所有限公司中标,中标价为200元/片。这是全国省级平台首次公布疫苗采购价格。
据国务院联防联控机制12月19日召开的新闻发布会,中国新冠肺炎首批接种人数预计将达到5000万人次。1月15日完成第一次接种,2月15日完成第二次接种。如果北京生物制品研究所的新冠肺炎灭活疫苗(Vero细胞)已经申报上市,那么在疫情持续的情况下,它必将享受目前的特别评价和优先评价,并很快获批上市,这意味着新冠肺炎疫苗在中国的大规模使用将越来越近。
然而,CDE已经接受了北京生物制品研究所的新冠肺炎灭活疫苗(Vero Cell)上市申请。无论是CDE工作人员的操作失误,还是国家的原因,美国食品药品监督管理局都另有考虑