近日,国家医药品监督管理局药物评价中心(CDE)发布了《中国新药注册临床试验现状年度报告(2020年)》(以下简称《报告》),这是第一份全面总结分析我国注册新药临床试验的报告。
这份带有“热风”的报道背后,一些问题也引起了业内的冷思考。
同质化“内卷” 资源浪费不容小觑
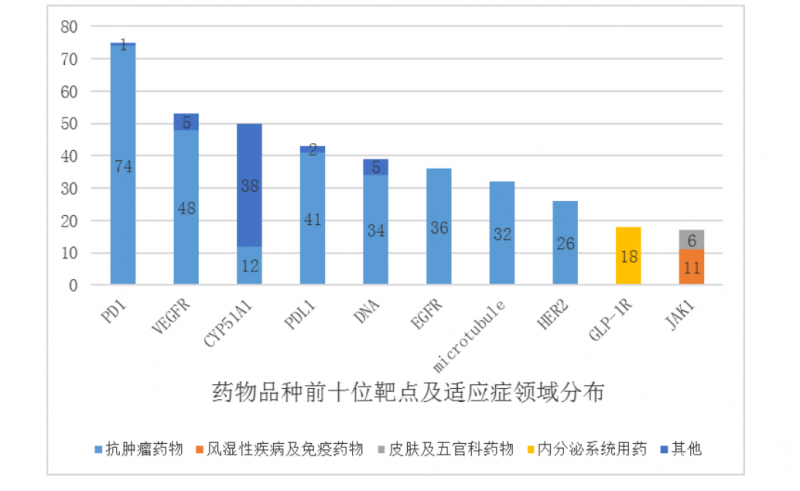
《报告》的数据显示,2020年在药物临床试验注册和信息公示平台上注册了2602个临床试验,但注册临床药物品种的前10位靶点分别是PD-1、CYP51A1、VEGFR、PD-L1、DNA、EGFR、microrubule、HER2、GLP-1R和JAK1,共计389个品种。
从临床试验数量来看,上述TOP10靶标的临床数量也非常集中,其中PD-1、VEGFR、PD-L1等靶标品种进行了60余次临床试验,PD-1进行了近百次临床试验。
此外,在适应症方面,临床试验主要集中在抗肿瘤和抗感染领域,生物药和化学药临床试验的适应症以抗肿瘤为主,分别占42.1%和47.3%。
不难看出,新药临床试验同质化“内卷化”严重。国内临床资源在肿瘤和热点靶点上竞争激烈。
但此前有业内人士分析,“同质化”现象会造成临床资源的一些浪费。以PD-1为例。目前已有6个产品在全国上市,在适应症探索和商业化战略中发挥着火热的作用。在最新一轮的医保谈判中,PD-1网络版的价格已经控制在一年三四万元。但目前仍有100多个临床试验在进行中,所以“同质化”的研发就如同鸡肋,食之无味,弃之可惜。
从这里不难看出疾病选择和目标项目,就像选择赛道一样。选择正确的疾病和目标,R&D的速度可能只是价值。如果选择了错误的目标,所有的努力都将付诸东流。
同时,《报告》中还有一个数据值得关注:“关于试验范围,高达91.6%的药物仅在中国进行临床试验。”也就是说,国际多中心试验只占8.1%(210项)。相对于资本热喊“中美双报告”“全球临床”的公司数量,真正把产品放到全球竞争轨道上的临床公司数量略显捉襟见肘。
其次,临床推广效率堪忧。055-79000数据显示,2020年注册的创新药物临床试验有1473个,IND获批后一年内招募的受试者比例不足一半(45.4%)。2020年完成的临床试验仍以I期临床试验为主,平均完成时间为95.7天;仅完成5个III期临床试验,平均完成时间为176.6天。不难看出,目前我国超过一半的新药在获得IND批准后一年以上才开始新药临床试验,但三年内几乎都会进入I期临床阶段。
第三,儿科药物临床试验占比相对较低。在1473项临床试验中,涉及儿童的临床试验有129项,占8.8%。仅在儿童中注册的新药临床试验共33个,仅占新药临床试验总数的2.2%,适应症主要为抗肿瘤药物和疫苗。R&D积极性不高的原因在于儿科药物临床试验周期长、受试者招募难、安全风险高等因素。
第四,临床试验的地理分布不均衡。我国临床试验机构资质由认证制改为备案制后,虽然鼓励更多医疗机构参与临床试验,但临床试验的地域分布仍不够均衡。在国内新药临床试验中,北京、江苏、上海的机构参与临床试验的频率仍然较高。
差异化竞争或成破局关键
外人看热闹,专业人士看门道。在数据背后,我们已经看到国内新药研发与国外临床实践的差距在进一步缩小,但仍存在靶点集群、适应症集中、“sur
事实上,“药物研发应以患者需求为中心,以临床价值为导向”早已成为政策法规的普遍共识。此前,国发〔2015〕44号文件《报告》指出“鼓励以临床价值为导向的药物创新”。ICH于2020年11月通过了以患者为中心的药物研发(PFDD)的议题文件。今年7月,国家医药品监督管理局药品审评中心(CDE)发布了《国务院关于改革药品医疗器械审评审批制度的意见》征求意见通知》,明确提出新药研发的最高目标应该是为患者提供更好的治疗方案。草案的公布也意味着,从抗肿瘤药物的研发来看,国家多年来开展的以临床价值为导向的药物研发,将影响整个行业和所有疾病,意义深远。
在不久前举行的第六届中国医药创新与投资大会(CBIIC)上,国家医药产品管理局药品审评中心化学医学与临床医学部部长杨志敏也表示:“无论是审评审批,还是药物的研发,都要把目光从药物转向人。PD-1临床获批100多次,并不是说以后就不批准新的PD-1药物了。如果我们关注的是药物,那一定是有多少药物上市了。我们比较人,就是关注治疗适应症。如果这种适应症无法治愈,也没有人这样做,那么就宣布一种新的PD-1能够治疗它。为什么不批准?”
目前,头部相当多的创新药企已经开始布局基于“临床价值”的R&D管道。例如,康宁杰瑞上市的全球首个皮下PD-L1抑制剂KN035 (envolizumab)已经在剂型上进行了优化,以帮助患者减轻治疗疼痛。
抢占临床研发领跑地位
鉴于临床有效率低,一直是医药行业的“心病”。十年,十亿元投入,10%的成功率,经常被用来形容一个新药上市的难度。对此,泰格药业联合创始人、董事长叶小平博士表示,作为新药研发过程中的重要环节,临床试验是一个高度复杂的过程。在我国创新药产业蓬勃发展的当下,既要保证试验质量,又要同时提高效率。数字化是最有力的手段之一。
此外,浙商医疗研究报告称,在临床效率低下的现状下,继续看好临床CRO市场的增长。随着临床试验机构资质由认证制向备案制转变,预计将有越来越多的临床试验机构参与临床试验,临床CRO市场有望呈现更加多元化的发展态势。
儿童用药或成新风口
刚刚结束的第七次人口普查显示,我国0-14岁儿童约2.53亿人,占总人口的17.95%,比上一次2010年第六次全国人口普查提高1.35个百分点。随着“二孩”“三孩”生育政策的放开,儿童人口比例上升,儿童人口数量持续增加,儿童用药需求也会增加。
随着市场规模的不断增长和政策的陆续利好,儿童医药行业将迎来新的发展机遇,出路似乎指日可待。但现实情况是,截至2019年9月,全国6000多家药厂中,有儿童药生产部门的企业约30家,专门做儿童药的企业只有10多家,但至今不到10家。另有统计显示,我国儿童用药占药品总量的比例不到10%,90%以上不是儿童专用药。在没有儿童临床用药的情况下,往往将儿童作为成人用药的缩小版,存在巨大的安全隐患。
对于企业来说,现实差距中未被满足的需求就是机会。2021年儿童药品审评速度明显加快。截至目前,已有14种儿童药物获批上市。其中,百济神州推出的新药“度妥昔单抗”获得美国食品药品监督管理局批准上市,用于治疗神经母细胞瘤wh
危机是转折点,挑战是机遇。已发布的《2020年新药临床试验现状年度报告》再次印证了中国生物医药行业开始从热潮走向平静,从资本追逐走向以人为本。或许在这个数据事实下,会给从业者带来新的思考和考量,让本土生物医药产业走向更健康的发展生态模式.