编译柯
8月12日,Celleron Therapeoutics宣布与罗氏签署许可协议,获得后者癌症研究药物emactuzumab的全球独家临床开发、生产和商业化权利。预计2020年底完成全部移交。两家公司没有透露交易金额。

据介绍,emactuzumab(RG7155)是一种研究型单克隆IgG1抗体,旨在靶向并清除肿瘤组织中的肿瘤相关巨噬细胞(TAMs)。TAMs是许多肿瘤微环境类型的丰富成分,可通过抑制局部免疫系统和促进肿瘤细胞生长来支持肿瘤的发生。Emactuzumab通过与细胞表面的集落刺激因子-1受体(CSF-1R)结合并阻断其被巨噬细胞集落CSF-1激活,特异性靶向TAMs。已证明用该药物治疗可显著减少腱鞘巨细胞瘤(TGCT)和癌症患者中的CSF-1依赖性巨噬细胞。
TGCT是一种罕见的疾病,其特征是关节和腱鞘中的滑膜组织增生,而弥漫性TGCT的特征是滑膜组织中的巨噬细胞增生。虽然这种疾病很少转移,但它是局部侵袭性和致残性的。标准疗法是手术,但复发率很高,患者的生活质量往往受到肿瘤相关症状和手术后遗症的影响。2019年8月,FDA批准第三共产党的Turalio(pexidartini)用于治疗成年TGCT患者。但这种药仅限于不能手术者,并附有肝毒性的警示标签。
2018年,emactuzumab联合检查点抑制剂Tecentriq进行的临床研究表明,与单独使用Tecentriq相比,联合治疗在实体瘤中的效果不如预期。同年,罗氏还准备开始另一项针对淋巴瘤患者的联合试验,但在第一个受试者注册之前退出了研究,并将这项资产搁置。当时,罗氏表示不存在安全性或有效性问题,这一决定标志着罗氏对开发这一资产的兴趣结束。
但这份许可协议表明,Celleron似乎非常看好emactuzumab的未来。Celleron计划用这种药物治疗弥漫性TGCT。罗氏及其子公司基因泰克之前的研究表明,emactuzumab在这一特定靶点上表现出非常令人鼓舞的疗效。在这项研究中,接受emactuzumab治疗的86%(24人)TGCT患者对该药物有反应,其中68%的患者在开始治疗后6周内出现部分反应。受试者包括曾尝试伊马替尼或尼罗替尼但没有持久效果的患者。
除了罗氏授权的资产,Celleron还在2009年与阿斯利康建立了双重机制组蛋白去乙酰化酶(HDAC)抑制剂AZD 9468(现名为CXD101)的全球许可合作关系。Celleron正在使用其CancerNav平台预测生物标志物,以确定最有可能对药物产生反应的肿瘤,评估CXD101作为单一药物以及与检查点抑制剂联合使用的疗效,并在中国开始新的试验。此外,公司另一项资产——拓扑异构酶抑制剂CXD201在结直肠癌患者中的应用也已进入2期临床研究。
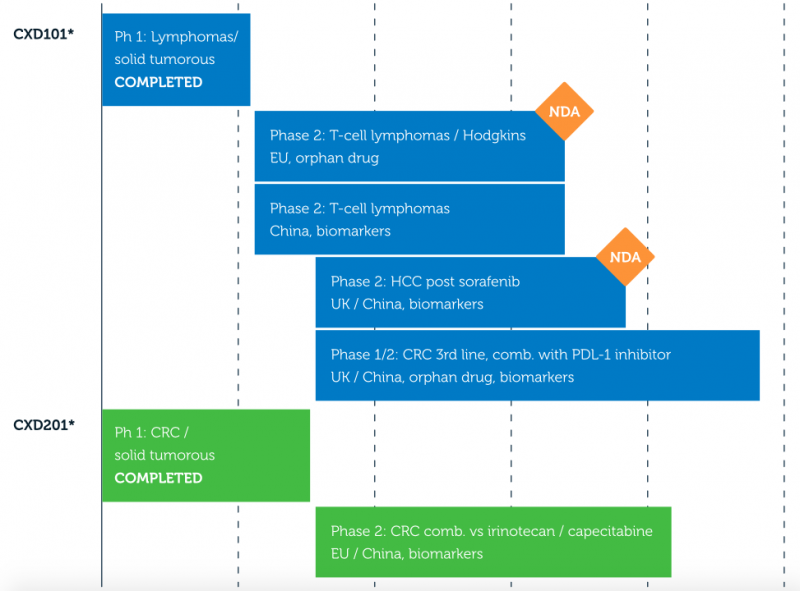
赛乐龙R&D管道及其临床进展
1、Celleron Therapeutics获得被搁置的罗氏药物的全球权利
2、Celleron Therapeutics与罗氏达成许可协议,以改善腱鞘巨细胞瘤患者的生活
