最近海思科被报道大获成功。3月29日,其连续发布了两次产品公告。海斯克制药集团有限公司的全资子公司四川海斯克制药有限公司的全资子公司海斯克制药(眉山)有限公司,收到国家美国食品药品监督管理局颁发的《药品注册证书》,获准仿制3种申报产品的阿伐那非名称,视为评价。此外,海思科制药集团股份有限公司创新药物HSK21542注射液用于腹部内镜手术后镇痛的期临床试验方案已于近日获得CDE批准,可启动期临床试验受试者群体用药工作。
毒品相关信息
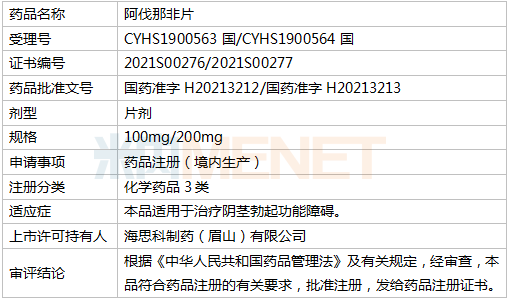
资料显示,阿伐那非片最初由日本田边三菱制药有限公司研发,经美国VIVUS公司授权,用于治疗男性勃起功能障碍。它于2012年4月在美国上市,商品名为Stendra。2013年6月,获准在欧盟上市,商品名为Spedra。目前已在美国、德国、法国、意大利等国家上市,国内尚未生产或进口。海斯克研发的Avanafil是国内第一个仿制的。
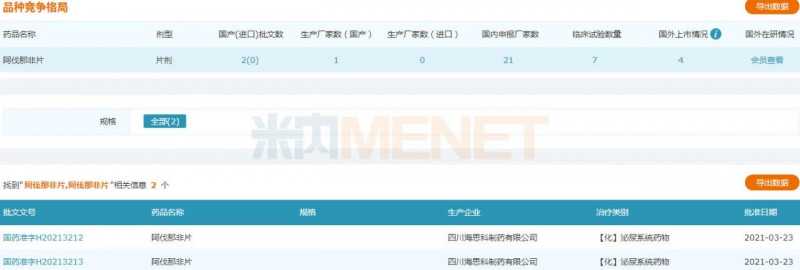
Avanafil片剂是由海斯克公司开发的非专利产品。该产品于2016年8月获得美国食品药品监督管理局颁发的《药物临床试验批件》号证书。完成BE研究和三期临床研究后,于2019年7月提交上市申请。Minenet数据显示,2019年,全国城市公立医院、县级公立医院、城市社区中心、乡镇卫生院(国内简称公立医疗机构)、实体药店终端抗ED药物市场规模超过33亿元。
同日,海思科还发布公告称,海思科制药集团股份有限公司的创新药物HSK21542注射液近日获得CDE批准,可进行腹部内镜手术后镇痛的三期临床试验,三期临床试验的受试者可开始分组服药。
药品基本情况

HSK21542是海斯克自主研发的具有完全自主知识产权的新型分子实体化合物。它属于一种有效的外周受体激动剂,旨在用于镇痛和治疗慢性肾病相关瘙痒(CKD-aP)。截至公告之日,世界上没有类似的化合物获准上市。目前Cara Therapeutics Inc .(NASDAQ:Cara)研发的kor Suva(Cr 845/difelikafalin)是同类化合物研发中最先进的。
HSK21542于2019年10月至2020年10月在澳大利亚进行I期临床试验;2020年1月至2020年9月在中国进行I期临床试验;从2020年6月至2021年2月,在中国进行了一项关于腹部内窥镜手术后镇痛的II期临床试验。根据初步临床试验数据的结果,公司做出了进入三期临床试验的决定。除了上述适应症和临床试验,HSK21542目前正在血液透析受试者中进行II期临床试验。