药明康德:Church教授您好,很高兴能与您交流。作为应用基因编辑技术的大师,在您看来,基因编辑技术在生物技术的发展历史上有着怎样的地位?它的下一个重大突破又会是什么?
乔治丘奇教授:哺乳动物的基因编辑始于20世纪80年代,并不断取得进展。提到基因编辑技术,有些人首先想到的是CRISPR。但我不认为CRISPR是最伟大的基因编辑技术。虽然我参与了CRISPR技术的改造,但出于谦虚,我不说这个。
在我看来,真正的基因编辑革命发生在重组DNA技术诞生后不久,远在CRISPR技术出现之前。这就是马里奥卡佩基博士和奥利弗史密西斯博士获得2007年诺贝尔奖的原因。那才是真正的基因编辑技术。这项开创性的工作是在老鼠身上完成的。为了将其应用于其他生物,需要进行一系列持续的改进,包括使用归巢核酸内切酶(meganucleases)、锌指核酸酶(ZFNs)、TALENs和CRISPR来产生靶向双链断裂。这些都是基于卡佩基博士和史密斯博士工作的稳步改进。现在,这些基因编辑技术基本上可以应用于所有生物。
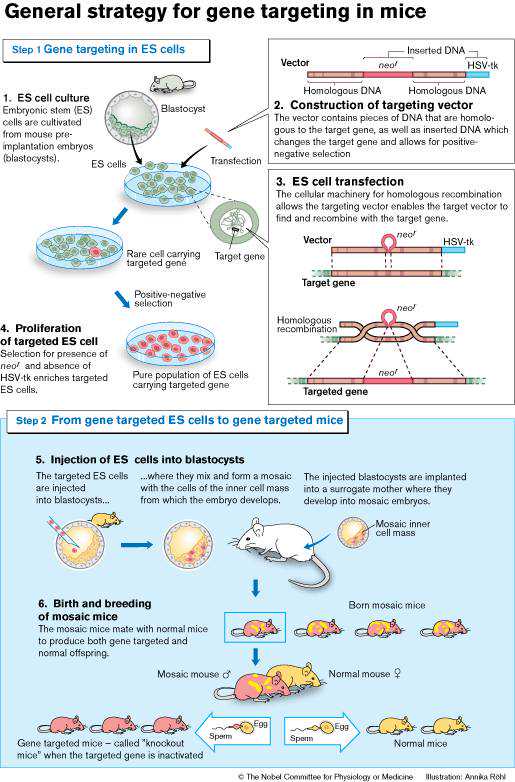
“利用胚胎干细胞将特定基因修饰导入小鼠体内的原理”发明人,2007年获得诺贝尔生理学或医学奖。(来源:诺贝尔奖官网)
这里,read的突破在于我们在“读”和“写”DNA方面的进步。回到你的第二个问题。下一个大突破会是什么?我认为将是“写”DNA的能力,而不是“编辑”DNA。这是一系列能带来巨大影响的渐变,包括添加基因、删除基因(或减少基因表达)、精确编辑。最终,我们可以在任何地方写出任何你想要的基因。
药明康德:在您看来,什么疾病最适合采用基因编辑治疗?您觉得其中有什么限制吗?
乔治丘奇教授:目前,大约有2400种基因疗法被批准进行临床试验,其中大部分涉及添加一种基因,少数涉及使用RNAi、ZFNs和TALENs来削弱基因功能。然而,几乎没有涉及精确基因编辑的疗法。
参考:基因治疗管道在四个疾病领域的巨大市场点
药明康德:您怎么定义精准基因编辑?
乔治丘奇教授:当基因被添加时,它们可以被插入到染色体上的任何位置。要去除或下调一个基因,你要么引入一个干扰分子,要么直接攻击基因,把它搞得一团糟。某种程度上,这也是随机的。几乎没有办法完全移除一个基因。
精确的基因编辑是指取一个胸腺嘧啶加一个腺嘌呤的操作,或者只是去掉4个碱基,不多不少。这是精确的编辑。相信大家都做过类似编辑的事情,或者至少和编辑打过交道。你不会把“从一本书里撕下一整页”的行为称为编辑,但这就是目前的情况。当大多数人谈论基因编辑时,他们实际上是在谈论把基因组弄得一团糟。
药明康德:那要怎样才能实现精准编辑呢?
乔治丘奇教授:方法很多,但是效率低很多。人们也倾向于完成简单的任务,他们会说:“我不想要树顶上的水果。可能是酸葡萄心理。我最好摘靠近地面的水果”。但如果真的能像基因敲除一样方便地进行精确的基因组编辑,我们会选择后者。
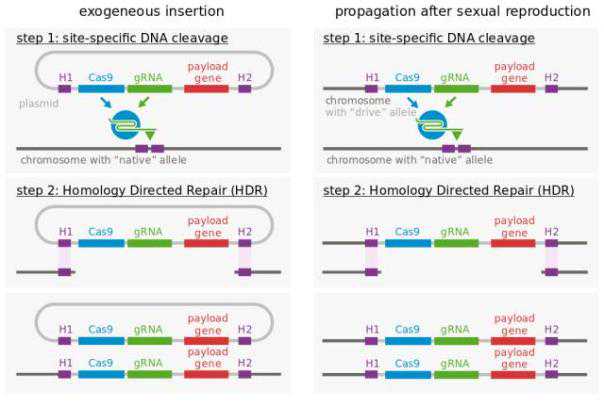
以镰状细胞贫血为例。这是一个简单的点突变,腺嘌呤(A)变成了胸腺嘧啶(T)。你只需要纠正这一个碱基。但实际上,我们是在兜圈子。我们会说,也许有一个基因,我们把它突变后,也能达到同样的效果。囊性纤维化也是如此,主要原因只是缺少3个碱基。世界上有数百种疾病。为了治愈它们,我们只需要将基因恢复到野生状态。我们不必做基因敲除。
镰状细胞性贫血是一种遗传病,由HBB基因的单核苷酸多态性(A变成T)引起,基因位于11号染色体上(图片来源:维基百科)
药明康德:关于基因编辑,最主要的伦理担忧是什么?
乔治丘奇教授:主要是安全性和有效性,就像美国FDA和欧洲EMA批准的很多新技术一样。当然也有一些投机性的担忧,比如几代之后的潜在影响,基因的不兼容,或者选择后代特征的商业行为。
药明康德:您能举一下几代后出现的潜在效果,以及基因不兼容性的例子吗?
乔治丘奇教授:在你知道之前,这些都是推测性的担忧。这就像第一颗原子弹引爆前,人们担心它会与大气中的氮同位素发生连锁反应。这当然没有发生,但人们仍然对此感到担忧。不管怎样,人们终于尝试了原子弹。
“几代之后才会出现的影响”真的只是假设。如果你展望四代人的寿命,他们确实比今天的人短,因为现在营养更丰富了。但我想说,这是因为表观遗传学对每一代人都有潜在的影响。比如有些突变会随着代数积累,我们可以做一个预测,知道在哪一代突变会发生量变,引起质变,导致亨廷顿舞蹈症等疾病。
基因不相容假说有点像药物不相容。我婆婆需要大剂量的布洛芬。当我去药房给她拿药时,我发现布洛芬与她正在服用的甲氨蝶呤不相容。在遗传学的层面,类似的事情也会发生。比如果蝇的P元件在一种果蝇中是无害的,但在基因组不相容的果蝇中会造成大量的随机损伤。
药明康德:您谈到了表观遗传学。它在基因编辑中起到了怎样的作用?
乔治丘奇教授:表观遗传学在所有遗传学中无处不在。有些人在提到一些神秘事件时会用表观遗传学这个词,但它确实有所指。这就是遗传学的工作方式。在植物中,可遗传的表观遗传学已经得到了很好的研究,它也带来了潜在基因“编辑”的手段。我们知道如何表观遗传地重新编码哺乳动物细胞,使它们从一种类型变成另一种类型。这和基因编辑有关,但关系不密切。只是一个可以查看的链接。
我们应该知道基因编辑的所有可能后果。通常,你需要了解表观遗传学。比如我改变一个基因的启动子,这个基因的表达就会受到影响,表达水平下调。这都是后生的。通过对表观遗传因子的基因改造,你就能明白它的后果。
药明康德:您对基因编辑的应用持有任何保留意见吗?
乔治丘奇教授:我已经提到了基因编辑在人类中的临床应用。它还可能对农业或野生物种产生其他潜在影响。基因驱动就是这样一个例子。我在哈佛的研究小组是最早公开提到这些影响的人之一,我们也讨论了潜在的解决方案,包括生物控制、反向驱动和“雏菊驱动”(一种自限驱动系统)。
基因编辑面临的主要问题是,人们希望拥有控制权。他们不想让这种生物失去控制,跑到野外,他们也不能把它带回来。我们可以预见一个潜在的问题,基于CRISPR的基因编辑的驱动模式是不可逆的。因此,我们在可逆性和可控性方面做了大量的工作。我们如何在实验室中控制这些微生物?或者说如果要把这些动物放生到野外,如何保证它们被限制在岛上?我们正在解决这样的问题。
参考:基因驱动技术会给我们惊喜吗?
药明康德:您能介绍一下雏菊驱动吗?
乔治丘奇教授:这是一种控制手段。简单来说,在这个系统中,基因驱动1是基因驱动2所必需的,基因驱动2是基因驱动3所必需的。基因驱动3遍布全岛的时候,基因驱动1和2早就用完了。因此,即使基因驱动的蚊子或老鼠逃到岛上,它们也没有能力传播到整个大陆。这种方式看起来很像菊花链(编者注:一种环形网络拓扑),所以我们称之为菊花链。
药明康德:在把基因驱动应用到农业和野生物种上,有足够的政府监管吗?
乔治丘奇教授:每个政府都有规定,我认为目前的政策刚刚好。比如你要在美国放生野生动物,需要FDA、EPA(环境保护局)、USDA(美国农业部)的批准。FDA希望保护动物的福利,USDA希望保护现有的动物,EPA希望确保动物不会失去控制。这些机构的结合对于野生动物的放生是非常有力的。
我认为基因驱动技术将会得到改进。但即使“雏菊车道”如我们所想的那样起作用,仍然可能有动物从一个国家逃到另一个国家。这意味着我们需要使用另一种国际体系,也意味着我们需要得到世界各国的认可。例如,由于治疗需求如此严峻,联合国可以获得所有国家的许可,使用基因驱动的方法来消灭传播疟疾的蚊子。
药明康德:我们再聊聊基因疗法吧,对患者来说,想让他们理解基因编辑对他们的影响,最大的挑战是什么?
乔治丘奇教授:所有父母都有5%的几率生下一个患有严重遗传疾病的孩子,这并不仅限于那些有家族遗传疾病的父母。这些疾病的治疗费用可能高达2000万美元。所以我们所有人都应该通过遗传咨询了解自己的DNA信息。——单基因测序只要80美元,全基因组测序只要1000美元。——不编辑基因,可以预防遗传病。个人遗传学教育项目等组织正在创造性地帮助人们获得遗传学知识。
药明康德:您是说当人们理解自己的遗传信息后,他们会对遗传病传给下一代变得更谨慎吗?
乔治丘奇教授:这就是我想说的。有些群体通过选择结婚对象,基本上消除了泰-萨克斯病。要达到这个目的,你不需要严格限制你的约会对象或者恋爱对象,但是有一小部分人是不会介绍给你的(作为结婚对象)。但这比治疗费用要少得多。诊断出泰-萨克斯病的遗传风险只有80美元,但如果你不幸生下一个患泰-萨克斯病的婴儿,这将花费数百万美元,同时也会给你的家庭带来痛苦。目前,我们没有治愈泰-萨克斯病的方法。即使有,也可能像其他获批的孤儿药一样终身治疗。
阅读:药明康德集团企业明明生物科技发布无创孕前基因筛查产品——“福玛”
药明康德:谈到基因编辑的短期和长期副作用,您最担心的是什么?
乔治丘奇教授:理想情况下,我们应该在大型人体器官上做实验,这样就不用让人冒险了。因为脱靶效应是基因组特有的,所以这样的实验是必要的。
我觉得副作用有两种,一种是脱靶编辑效果,一种是你可以准确编辑,但是出现了一些你没想到的复杂生理反应。只要你把基因改回正常状态,第二个就不太可能出现了。
所以我觉得脱靶效应是最有可能的问题。你无法真正预测会发生什么脱靶效应,所以找出脱靶效应的唯一方法就是通过大量的人体实验。但我们无法在大量人体内编辑基因,导致鸡生蛋,蛋生鸡的问题。我们还是要先编辑人体器官中的基因。那么,没有人怎么会有人体器官呢?它们可以在实验室生产。人造器官可能达不到移植的标准,但足以进行临床前试验。这只是我的猜测,并不是行业共识。但我想你可能需要测试一下安全性。理想情况下,在进入人体之前,最好在人体器官内进行实验。
药明康德:再聊聊未来吧。未来5-10年里,基因编辑技术会经历怎样的发展?
乔治丘奇教授:它将呈指数增长,就像读写短DNA序列的能力已经发生的那样。几年间,我们取得了百万倍的进步。这些读写能力是新基因组技术“生态系统”的关键部分,其中也包括基因编辑。
药明康德:你说读写短DNA序列的能力在几年内提升了一百万倍。这到底是什么意思?
乔治丘奇教授:这是指下一代测序技术。我们可以将人类基因组的测序成本从30亿美元降低到1000美元,这是在6年多的时间里实现的。这就是我所说的指数增长。除了阅读短DNA序列,我们还学会了如何更好地合成短DNA,这比几年前简单了数百万倍。两者都是通过“分子复用”技术实现的。这些都是指数增长的例子。我认为基因组编辑、组装、编译的价格变化也会经历类似的发展曲线。
参考:快递|百元基因组时代来了!Illumina推出新的测序仪
药明康德:那您能再说一下基因组技术“生态系统”吗?
乔治丘奇教授:这就像一个由技术人员和临床医生组成的小组。我们有一个基因组技术的生态系统,人们可以编辑基因组,但不仅仅是基因组。如果你不能读懂基因组,你就不能成为一名编辑。所以这是一种更简单的DNA阅读技术和合成技术的结合,可以创建大量的文库。这些基因组工具,现在看起来很神奇,将成为下一轮指数增长的燃料。
阅读:前沿|首次实现关键基因一步转化,合成生物学大有作为。
药明康德:您认为我们实现了人类基因组计划的愿景吗?
乔治丘奇教授:首先,我不是那种承诺会带来治愈方法的人。我们的研究小组专注于改进技术。顺便说一下,我们还没有完成任何人的基因组测序。有人说人类从未登上过月球,但我认为已经登上过了。然而,我们还没有完成人类基因组测序。我的研究小组正在使用一种全新的方法,有望实现这一目标。
所以答案是肯定的。我认为人类基因组计划带来了很多技术应用,不仅仅是测量30亿个碱基对。现在我们可以反复读取基因组数据,诊断疾病,了解基因与疾病的关系,利用基因读写技术治疗疾病。我想我们已经实现了这个愿景。现在我们有一个健康的产业合作体系。例如,数百万妇女接受了非侵入性产前筛查(NIPT)。几年前,这个数字是零。为什么不是每个人都能充分体验到基因组测序的好处?
药明康德:将基因编辑疗法带给患者,最大的挑战是什么?
乔治丘奇教授:临床试验。临床试验费用昂贵,基因编辑疗法需要金钱和时间才能获得FDA的批准。八年内很难有新药上市。临床试验开始后,将对患者进行治疗。如果这个药效果特别好,那么第一年就有可能看到疗效。但这并不意味着它可以上市。上市需要很多年。
药明康德:您认为这样的流程会最终改变吗?
乔治丘奇教授:一方面,我认为这个过程应该更好,这样我们才能尽快完成临床试验。但另一方面,我希望在我们准备好之前,法律不会被改变。总有一些人想走捷径。2000年,一些基因疗法在两次临床试验中夺去了三个人的生命,最终导致了基因疗法发展的倒退。我觉得是因为研究者有点草率。
现在世界上大部分国家对基因编辑持谨慎态度。我觉得应该有严格的监管,但也应该有创新。一旦有了创新,严格的监管才能带来创新的治疗和诊断手段。他们应该能表现得很好。
参考:明星科学家一夜之间成为罪人,他用了16年时间救赎自己。
药明康德:您认为基因编辑生态系统里的新技术,对公众的理解会是个挑战吗?
乔治丘奇教授:公众理解是一个巨大的挑战。可惜基因组技术没有像其他东西一样引起人们的关注。人们更喜欢谈论明星、体育和消费品。
虽然风险高,但是没有人真正去思考这个问题。如果你的孩子很健康,父母根本不在乎基因诊断。这就是为什么没有人谈论基因组技术。但是你要知道,有遗传病孩子的父母需要辞职来照顾孩子或者筹集资金。大多数人都觉得这些事情不太可能发生在自己身上。如果遗传病的概率是5%,大家都觉得自己属于另外95%。但是他们怎么能确定呢?我们要测试基因后才能知道。
所以我们需要像汽车安全气囊这样的东西。每年全球仍有100万人死于车祸,但很少有人死于带安全气囊的汽车。如果没有安全气囊,更多的人会在车祸中丧生。所以即使基因突变非常罕见,人们也不能免疫,所以我们将分析基因组。基因测序现在已经够便宜了,我们只需要去做就行了。
药明康德:那么基因编辑疗法的价格会成为患者应用的主要挑战吗?
乔治丘奇教授:我们所有基因(编者注:外显子)测序的成本已经降低到80美元,全基因组测序的成本已经降低到1000美元。但是基因编辑疗法仍然价值数百万美元。疾病越罕见,医疗费用越高。不过,遗传病虽然对个体来说概率低,但对群体来说相对常见。世界上每年有5%的新生儿有缺陷。我相信这种情况会随着时间的推移而改变。降低基因组测序的成本需要时间,但基因编辑疗法还没有迎来这样的拐点。所以目前,价格将是一个问题。
这也是为什么基因咨询很有吸引力,但是人们直到生病才会想到医生。家里有人生病了,就问“基因疗法”在哪里。事实上,在生病之前,人们可以花80美元或1000美元来了解基因信息。但目前的情况是,人们在生病后宁愿选择100万美元的解决方案,也不愿采取负担得起的方法来避免问题。
关注药明康德微信官方账号
