当地时间12月1日至4日,美国血液学会(ASH)第60届代表大会在圣地亚哥召开。在今天的报道中,我们将与读者分享中国新型生物医药产业取得的一些进展。
百济神州公布PD-1单抗治疗淋巴瘤,完全缓解率达61.4%
百济神州带来的Tislelizumab(BGB-A317)是正在研制中的人单克隆抗体,能与细胞表面PD-1受体高亲和力、高特异性结合。根据临床前数据,tislelizumab的Fc段的修饰可以最大限度地减少与其他免疫细胞的潜在负面相互作用,因此它与目前批准的PD-1抗体有潜在的不同。
今天公布的临床数据来自一项单臂、开放标签、多中心的关键2期临床试验。在本试验中,tislelizumab被用于单药治疗中国复发或难治性经典型霍奇金淋巴瘤(R/R cHL)患者。截至今年5月,70名患者的数据可用于评估。独立审查委员会的分析显示,该抗体实现了85.7%的总体应答率(ORR),其中完全应答率(CR)为61.4%,部分应答率为24.4%。接受自体干细胞移植的患者中,92.3% (12/13)获得客观缓解,完全缓解率达69.2%。
“我们报道的优异结果包括高的完全缓解率。这是首次对这种潜在不同的抗PD-1抗体的注册进行研究,我们对此感到兴奋。”百济神州血液科首席医疗官黄伟娟博士在新闻稿中说。
百济神州公布两项zanubrutinib临床研究数据
Zanubrutinib是一种正在开发中的bruton酪氨酸激酶(BTK)的小分子抑制剂,目前正在世界各地进行广泛的关键临床试验。它可作为单一药物使用,也可与其他疗法联合使用,用于治疗各种淋巴瘤。
在ASH大会上,百济神州公布了zanubrutinib的两项临床研究数据。在一项治疗复发性或难治性套细胞淋巴瘤(MCL)的关键2期临床试验中,研究人员评估了zanubrutinib作为单一疗法用于中国患者的潜力。独立审查委员会的分析显示,该药物的总缓解率(ORR)为83.5%(71/85),其中完全缓解率(CR)为58.8%,部分缓解率(PR)为24.7%。
在世界上许多国家进行的另一项1期临床试验中,zanubrutinib被用作治疗多种B细胞亚型淋巴瘤的单一疗法。研究者的评价结果显示该药的ORR为88.9%(40/45),其中CR为26.7%,PR为62.2%。
“这两项临床研究提供了令人鼓舞的数据,支持zanubrutinib作为MCL的潜在疗法。”百济神州血液科首席医疗官黄伟娟博士在新闻稿中提到。
目前,zanubrutinib用于治疗复发性或难治性MCL和复发性或难治性慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)的NDA已被中国国家医药产品监督管理局(NMPA)受理,用于MCL的NDA已被纳入优先审评范围。百济神州计划于2019年或2020年初向FDA提交zanubrutinib在美国的首个NDA。
亚盛医药公布HQP1351治疗慢性骨髓性白血病的最新进展
HQP1351是亚圣药业研发的一类新药,是一种高效口服第三代BCR-ABL抑制剂。它不仅可以靶向野生型BCR-ABL,还可以靶向T315I突变型BCR-ABL,有望用于治疗耐药慢性粒细胞白血病(CML)患者。

HQP1351的数据汇总(来源:参考文献[4])
在ASH会议上发表的最新数据显示,HQP1351耐受性良好,没有患者因治疗相关的副作用退出临床试验(TRAE)。在疗效评价方面,65例(93%)患者在三个治疗周期内获得了完全缓解。在接受3个或以上治疗周期的47例患者中,24例(51%)获得了主要细胞遗传学缓解(MCyR)。
值得一提的是,HQP1351在T315I突变患者中也具有较高的活性。这些初步结果表明,HQP1351作为第三代TKI,对目标患者是安全有效的。
南京传奇公布CAR-T疗法最新数据
南京联想带来的双特异性CAR-T疗法LCAR-B38M,近年来一直是业界关注的焦点。2017年,这种疗法的出现被认为是去年ASCO会议上最大的黑马之一。在今天的ASH大会上,南京传奇也更新了该疗法的最新安全性和疗效数据。
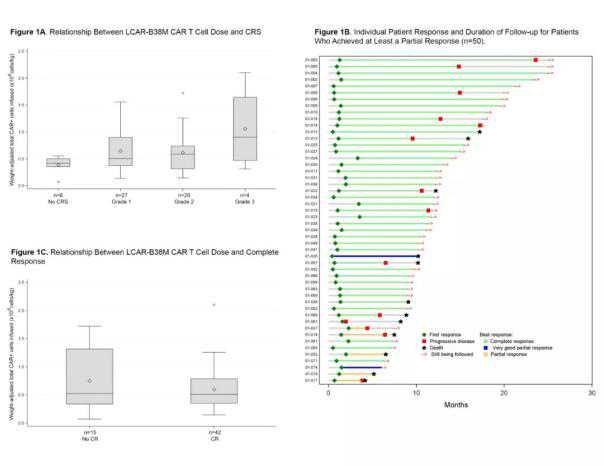
LCAR-B38M的部分数据汇总(来源:参考文献[5])
截至今年6月,共有57名患者接受了治疗,总有效率(ORR)为88% (95% CI: 76%-95%)。其中42例患者达到完全缓解(CR),占74% (95% CI: 60%-85%)。在获得完全缓解的42名患者中,多达39名患者被发现有阴性微小残留病变(MRD)。
未发现CAR-T剂量与缓解之间的相关性,并且其靶BCMA的表达与临床缓解无关。
参考资料:
[1] BeiGene在第60届美国血液学学会年会上介绍了Tislelizumab在复发/难治性经典型霍奇金淋巴瘤中的临床结果,检索于2018年12月3日,来自
[2]百济神州在ASH大会上公布了zanubrutinib的临床研究数据,检索于2018年12月3日,来自
[3]亚圣药业抗格列卫新药HQP1351的临床进展,入选美国血液学会2018年年会口头报告,2018年12月3日检索,来自
[4] 791第三代口服BCR-ABL抑制剂HQP1351对酪氨酸激酶抑制剂耐药的慢性髓性白血病患者的安全性和疗效:I期研究的初步结果,2018年12月3日检索自
[5] 955对复发/难治性多发性骨髓瘤患者的LCAR-B38M(一种针对B细胞成熟抗原的嵌合抗原受体T细胞疗法)1期开放标签研究的更新分析,于2018年12月3日检索自
关注药明康德微信官方账号
