近期,九价HPV疫苗、马来酸吡咯烷酮片等几个重磅药物在国内迅速获批上市。除了被纳入优先审查程序之外,‘有条件批准’贡献良多。下面列举几个申请国内有条件批准上市的新药,包括进口药和国内自主研发产品。申请主要针对恶性肿瘤和个别孤儿药,满足国内有条件审批的要求。
什么是有条件批准上市
一般来说,新药的安全性和有效性需要通过临床试验来验证,绝大多数新药上市申请必须基于III期验证性临床研究的临床终点结果来批准。但是,对于一些治疗严重危及生命或缺乏治疗手段的疾病的药物,如肿瘤、罕见病等,为了加快新药上市,药品监管部门会根据II期关键临床研究中的替代指标临时批准药品上市,以满足临床需要,但这种批准是有条件的,即企业需要在药品上市后继续完成验证性试验。
作为加快新药上市的快速通道,有条件批准并非中国首创,大部分应该是基于FDA在1992年建立的‘加速批准’,即对于严重危及生命的疾病,基于合理的替代终点或中间终点,同意加速药物的批准。目前我国支持临床急需药品和罕见病的必备条件审批。
中国有条件批准的官方支持文件
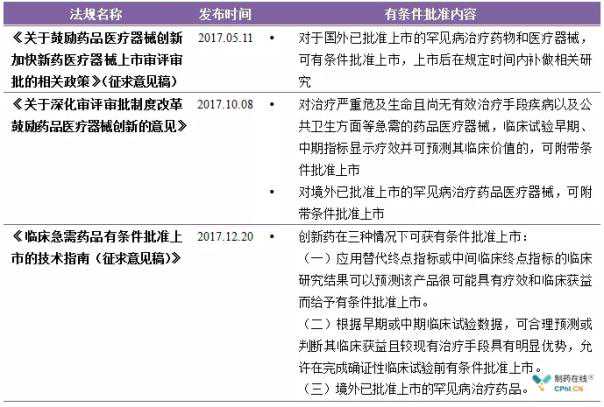
有条件批准是一种“先批准后验证”的药品监管制度,它带来了一些积极的早期好处,但也面临许多挑战。首先是选择合适的替代指标,需要能够准确预测或反映临床疗效和获益;其次,如何保证企业上市后能在规定时间内完成三期验证性临床,而不是放弃。
获得国内有条件批准上市的新药
奥昔替尼片
奥希替尼
奥替尼是阿斯利康开发的口服第三个代表性表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)。它能以EGFRm(TKI敏感突变)和T790M突变阳性(TKI耐药突变)的形式有效作用于EGFR,从而克服第一代和第二代EGFR-TKI的T790M耐药,成为T790M突变的非小细胞肺癌(NSCLC)患者的一线治疗药物。
Oxitinib更早已经被FDA认可为突破性疗法和孤儿药,并于2015年11月13日被FDA批准上市。2016年8月,阿斯利康向CFDA提交了进口注册申请,并于2017年3月24日通过纳入优先审查被CFDA有条件批准上市。它用于患有局部晚期或转移性非小细胞肺癌的成年患者,这些患者在过去用EGFR-TKI治疗期间或之后出现了疾病进展,并且测试证实EGFR T790M突变为阳性。
支持该产品有条件批准的主要依据是全球关键II期AURA扩展研究和AURA2研究,主要研究终点为ORR;结果显示ORR(N=411)为66.1%,DCR为91%,中位PFS为9.7个月。此外,中国的一项I期药代动力学研究和一项II期临床研究证实,中国患者的药代动力学特征与世界相似,暴露量不受民族因素影响。
九价人乳头瘤病毒疫苗
Gardasil 9
人乳头瘤病毒疫苗(人乳头瘤病毒)是世界上第一个以癌症为适应症的疫苗产品,由默克公司研发。它可以利用病毒上的特殊蛋白质外壳来诱导人体免疫,预防与人乳头瘤病毒感染相关的癌症的发生。
2018年4月,摩东向CDE提交了九价人乳头瘤病毒疫苗(9vHPV)的进口上市申请,并通过临床急需药品纳入优先审评。只用了8天。CFDA于2018年4月28日有条件批准了9vHPV的上市申请,用于预防16-26岁女性宫颈癌、外阴癌、阴道癌、肛门癌、生殖器疣和人乳头瘤病毒引起的持续感染。本次有条件批准是在以往二价和四价人乳头瘤病毒批准数据的基础上,充分采用国外临床试验数据,提出上市后进一步扩大中国人群临床研究和药学研究的要求。
FDA批准9-26岁女性和男性接种9vHPV,但中国的这个有条件批准只批准16-26岁人群接种。这是因为海外数据只对9-15岁接种者进行了免疫桥试验,而该试验针对东亚华人的临床数据有限,不良反应严重。后续将根据国内临床研究结果判断是否扩大接种年龄。
注射阿拉伯糖苷酶
肌酶
注射用葡萄糖苷酶,中文名为美赞臣,是赛诺菲的子公司Genzyme公司研发的药物,用于治疗庞贝氏病。也是目前世界上第一个也是唯一一个针对庞贝氏病的药物。它可以通过酶替代疗法来替代酸性-葡萄糖苷酶的缺失或缺失,从而达到治疗效果。美赞于2006年首次获得FDA批准,2010年5月获得FDA批准用于治疗8岁及以上晚发型庞贝病患者。2014年,它扩大了适应症,被FDA批准用于所有年龄或表型的庞贝患者。
赛诺菲于2015年6月向CFDA提交了该品种进口上市的三期临床试验豁免申请。CDE基于安全性和有效性的已完成临床试验,包括80名婴儿庞贝氏症患者和101名延迟庞贝氏症患者,以及当时正在进行的五项临床研究。同时,参考该产品在美国、欧洲、日本等国家上市后的用药经验,并考虑到罕见病的特殊性,CFDA于2015年11月4日同意有条件批准上市,但上市后需要进一步评估该产品对中国患者的有效性、安全性和剂量。
马来酸吡咯烷片
艾雷尼
马来酸吡咯烷酮片是江苏恒瑞自主研发的创新药物。它是一种以人类表皮生长因子受体2(HER2)和表皮生长因子受体(EGFR)为双重靶点的口服不可逆酪氨酸激酶抑制剂。它可以通过阻断HER2和EGFR的信号转导来抑制肿瘤细胞的生长。在一项针对蒽环类和紫杉醇治疗失败且复发/转移后化疗不超过2线的乳腺癌患者的II期临床试验中,吡咯烷卡培他滨(吡咯替尼组)的客观缓解率为78.5%,拉帕替尼卡培他滨(拉帕替尼组)的客观缓解率为57.1%,吡咯替尼组的客观缓解率增加了约21%,吡咯替尼组的客观缓解率增加了约21%。
凭借出色的II期临床试验数据,江苏恒瑞于2017年8月向CFDA提交了有条件上市申请。该应用的适应症是HER2阳性的晚期或转移性乳腺癌;2017年9月,以临床价值明显、重大项目为由,将该产品纳入优先审评程序。2018年8月13日,CFDA基于II期临床结果有条件批准马来酸吡咯烷上市。
壳聚糖膜
埃皮达扎
他苯胺片是深圳微芯生物科技研发的全球首个亚型选择性组蛋白去乙酰化酶口服抑制剂。通过抑制特定组蛋白去乙酰化酶(HDAC)亚型引起的染色质重塑和基因转录的调节,抑制淋巴和血液肿瘤的细胞周期,诱导肿瘤细胞凋亡,可用于治疗复发性和难治性外周T细胞淋巴瘤(PTCL)。
深圳微芯于2013年3月向CFDA提交了上市申请。支持该产品有条件上市申请的关键是一项多中心、单臂、非随机、开放性II期临床试验(n=83)。主要研究终点是ORR。临床结果显示ORR为29.1%(23/79),持续缓解率3个月为24.1% (19/79)。同时疗效与国外批准用于PTCL的三种药物相似,但在我国高发的难治性鼻亚型T/NK细胞淋巴瘤中表现出更好的疗效(有效率为18.8%)。基于现有的II期数据,CFDA于2015年1月7日有条件地批准该产品上市,用于过去接受过至少一次全身化疗的复发或难治性PTCL患者。
正在申请有条件批准的药物
盐酸安罗替尼胶囊
付伟
盐酸安罗替尼是一种新型小分子多靶点酪氨酸激酶抑制剂(TKI),是郑达天晴自主研发的1.1类创新药物。通过靶向多个受体(VEGFR1-3、PDGFR-、FGFR1-4、c-Kit)的酪氨酸激酶,抑制肿瘤血管生成,诱导肿瘤凋亡。2018年5月10日,安罗替尼胶囊在国内首次获批用于晚期或转移性非小细胞肺癌NSCLC的三线治疗。
据业内人士透露,郑达天晴乘胜追击,已将第二适应症“软组织肉瘤”提交给CDE,根据II期临床结果进行有条件批准。该适应症于2017年6月获得FDA授权的孤儿药资格,符合我国罕见病治疗药物条件批准的要求。2018年在ASCO口头发表的阿罗替尼治疗转移性晚期软组织肉瘤的随机、双盲、安慰剂对照、多中心II期临床试验结果显示,在233名患者中,阿罗替尼组(n=158)和安慰剂组(n=75)的主要终点分别是6.27和1.47个月的PFS,ORR分别为10.13%和1.37。同时,对于不同亚型的软组织肉瘤,滑膜肉瘤(n=57)、平滑肌肉瘤(n=41)和腺泡软组织肉瘤(n=56)的无瘤生存期分别为5.73和1.43个月以及18.23和3个月。
Zanubrutinib
Zanrutinib是百济神州自主研发的强效高选择性第二代bruton酪氨酸蛋白激酶(BTK)抑制剂。BTK在B细胞恶性肿瘤细胞中高表达,Zanrutinib可通过阻断其相关信号传递,抑制恶性增殖B细胞的生长,杀死肿瘤细胞。
百济神州已于近日向CDE提交了该产品针对复发性/难治性套细胞淋巴瘤(MCL)的有条件上市申请,并于8月27日被CDE受理。此次提交的上市申请主要基于对中国86例复发性或难治性MCL患者进行的单臂临界II期临床试验结果,剂量为160mg,每日两次。结果显示,总缓解率(ORR)为84%,其中59%的患者达到完全缓解。