原文:朱里口431
2019年国庆前夕,国家美国食品药品监督管理局(NMPA)发布《药品注册管理办法》(修订征求意见稿)。这份对我国药品注册管理进行全面梳理和重新定位的文件,一定会让爱学习的药企注册人员和相关技术人员纠结不已。
这份《药品注册管理办法》(征求意见稿)共分11章129条,涵盖了我国药品上市申请的方方面面,与多个领域的最新法规保持同步,涵盖了现实中存在但被以往法规忽略的问题。例如:疫苗管理的特殊要求、处方药向非处方药的转换、部分非处方药的直接应用、MAH身份的引入、各种优先审评审批(突破性治疗药物、有条件审批、优先审评审批、特殊审批)的具体要求、科研生产现场核查的具体实施以及与GMP检查相关的处理等。
注册人员必须从宏观角度出发重构自己的知识体系
医药行业以合规压力大、对从业人员素质要求高著称,而药企注册人员处于关键位置,承担着将R&D人员辛辛苦苦整理的数据按照药监部门规定的格式提交给相关部门的重任,并持续进行技术沟通,推动项目成功获批;所以,要求注册人员业务素质高,责任心强并不过分。
新《药品管理法》颁布后,国家美国食品药品监督管理局已明确表示,未来将高密度出台相关法规和指导原则;可以说,药企注册人员需要拟定新的学习计划,以迎接即将布局的新规定、新指导原则、新通知。
为了提醒注册人员重构知识体系,建议学习和研究以下规定和指导原则:
《中华人民共和国药品管理法》
《中华人民共和国中医药法》
《中华人民共和国疫苗管理法》
《中华人民共和国行政许可法》
《中华人民共和国药品管理法实施条例》
《药品注册管理办法》(草案和随后的最终文件)
《药品生产监督管理办法》(草案和随后的最终文件)
《药品经营监督管理办法》(草案和随后的最终文件)
《中国药典》(2020年版草案)
《对部分 ICH 三级指导原则转化实施建议公开征求意见的通知》中提到的ICH相关指南
《对 ICH Q 系列指导原则转化实施建议公开征求意见的通知》中提到的ICH相关指南
全国人大、国务院、国家美国食品药品监督管理局、省局等颁布的有关MAH的相关规定和指导性文件。.
当然,注册人员必须熟悉和掌握食品药品监督管理局颁布的过去仍然有效的法律文件。
药品上市许可持有人制度的全面引入
2016年开始的药品上市许可持有人(MAH)制度,可以说是近年来药品监管改革的核心政策变化。其目的是将药品注册与药品生产销售分开,充分调动社会各方面的积极性,实现资源的优化配置。
在新颁布的《药品管理法》修订版和《药品注册管理办法》(草案)中,突出了MAH的作用和责任。据统计,这份文件草案中有15条提到MAH在药品注册、临床试验实施、合规性检查、上市后研究、上市后管理等药品全生命周期中应承担相应的责任。
国庆期间,上海医药工业研究院因为拒绝接受FDA检查而被警告,也充分说明MAH和受托方之间的责任需要充分沟通和界定。
例如,《药品注册管理办法》草案第四十六条规定:(基本要求)药品注册检查是指对申请人的药物非临床研究、药物临床试验、申报的生产研发场所和生产现场实施的检查,必要时对药品注册申请中涉及的原辅包等生产企业、供应商或者其他委托机构实施的延伸检查。
以上规定和实例都说明,未来负责药品监管的MAH必须做好物质准备和心理准备,MAH所属的注册人员必须对职责和要管理的外部委托单位进行充分的风险评估和管理。
根据要求
《药品注册管理办法》(美国食品药品监督管理局[2016]86号)
《全国人民代表大会常务委员会关于授权国务院在部分地方开展药品上市许可持有人制度试点和有关问题的决定》(征求意见稿)
《总局关于做好药品上市许可持有人制度试点有关工作的通知》(美国食品药品监督管理局〔2017〕68号)
《关于鼓励药品医疗器械创新实施药品医疗器械全生命周期管理的相关政策》(2018年第66号)
国家医药产品监督管理局关于药品上市许可持有人试点工作中药品生产和流通有关事项的批复(国药监函〔2018〕25号)
《总局关于推进药品上市许可持有人制度试点工作有关事项的通知》(药监发〔2019〕237号)
各省局关于MAH试点项目的相关法规
在这一部分,我认为现行的MAH制度的监管框架还存在一些不足。建议引入药品上市许可申请人(MAA)的概念,以对应药品上市后承担管理责任的MAH。
临床试验管理的继往开来
药物临床试验是评价拟上市药物是否具有足够有效性和安全性的关键环节,也是药物研发中耗费资金较多的工作之一。自2015年7月22日起,食品药品监督管理局对临床试验合规性检查保持高压态势。应该说,临床试验的规范化管理和数据的真实性得到了极大的加强和保障。
修订后的《国家药品监督管理局关于药品上市许可持有人直接报告不良反应事宜的公告》草案不仅延续了《国家药监局综合司关于药品上市许可持有人持有药品批准文号变更生产场地有关问题的复函》(2007年修订)的大部分管理规定,还吸收和梳理了2015年以来药品监管改革的成果,包含了许多新的内容,如临床试验由审批制改为暗示许可制、境外临床试验数据的受理、GCP由认证制改为备案制、临床试验年报制度、临床试验的期限等。
应该说,从现在的《药品注册管理办法》草案来看,这个文件中提到的药物临床试验主要是为上市审批服务的。事实上,有一些临床试验的目的不是为了支持药品上市许可,而是为了其他目的。例如,一些临床试验旨在积累真实世界的证据,支持中医/循证医学证据,再生医学研究等。这些不以支持药物上市为目的的临床研究,在这份草案文件中没有提及,估计也受到了现行管理制度的限制。
在美国,FDA管理的IND有三类,分别是:研究者IND、紧急使用IND和治疗IND;只有最后一种ind研究旨在支持药品上市许可。
不过这个《药品注册管理办法》的草稿还是带来了一些思考。例如,第34条规定:(其他)正在进行临床试验以治疗无有效治疗方法的严重危及生命疾病的药物,可以受益于医学观察并符合伦理原则。经伦理委员会审查并知情同意后,可根据相关部门的相关要求,用于开展临床试验的机构中其他相同病情的患者。这里的规定类似于FDA管理的第二个IND——紧急使用IND。
根据《药品注册管理办法》草案这部分的要求,为了建立关于这部分工作的知识体系,建议药品注册人员学习:
《药品注册管理办法》(草案和随后的最终版本)
《药品注册管理办法》
《药品注册管理办法》(2018年第50号)
《药物临床试验质量管理规范》(2015年第117号)
《国家药品监督管理局关于调整药物临床试验审评审批程序的公告》(2015年第166号)
《关于开展药物临床试验数据自查核查工作的公告》(2015年第169号)
《国家食品药品监督管理总局关于进一步做好药物临床试验数据自查核查工作有关事宜的公告》(2015年第172号)
《国家食品药品监督管理总局关于药物临床试验数据自查情况的公告》(2015年第197号)
《关于药物临床试验机构和合同研究组织开展临床试验情况的公告》(2015年第201号)
《国家食品药品监督管理总局国家卫生和计划生育委员会中国人民解放军总后勤部卫生部关于开展药物临床试验机构自查的公告》(2015年第222号)
《总局关于药物临床试验数据自查核查撤回注册申请情况的公告》(2015年第228号)
《总局关于广东百科制药有限公司等八个企业撤回注册申请的公告》(2015年第229号)
《总局关于发布药物临床试验数据现场核查要点的公告》(2015年第255号)
《总局关于 8 家企业 11 个药品注册申请不予批准的公告》(2015年第259号)
《总局关于 90 家企业撤回 164 个药品注册申请的公告》(2015年260)
《总局关于 62 家企业撤回 87 个药品注册申请的公告》(2015年第264号)
《总局关于 14 家企业 13 个药品注册申请不予批准的公告》(2015年第287号)
《总局关于 82 家企业撤回 131 个药品注册申请的公告》(2016年第21号)
《总局关于 154 家企业撤回 224 个药品注册申请的公告》(2016年第45号)
《总局关于 128 家企业撤回 199 个药品注册申请的公告》(2016年第81号)
《总局关于 11 家企业撤回 21 个药品注册申请的公告》(2016年第92号)
《总局关于药物临床试验数据自查核查注册申请情况的公告》(2016年第109号)
《总局关于 7 家企业 6 个药品注册申请不予批准的公告》(2016年第113号)
《总局关于 15 家企业撤回 22 个药品注册申请的公告》(2016年第142号)
《总局关于药物临床试验数据自查核查撤回品种重新申报有关事宜的公告》(2016年第171号)
《总局关于药物临床试验数据自查核查注册申请情况的公告》(2016年第202号)
《总局关于药物临床试验数据自查核查注册申请情况的公告》(2017年第42号)
《总局关于药物临床试验数据自查核查注册申请情况的公告》(2017年第59号)
《总局关于药物临床试验数据自查核查注册申请情况的公告》(2017年第63号)
《总局关于药物临床试验数据自查核查注册申请情况的公告》(2017年80号)
《总局关于药物临床试验数据核查有关问题处理意见的公告》
《总局关于 106 家企业撤回 135 个药品注册申请的公告》(2015年第257号)
《临床试验用药物生产质量管理规范(征求意见稿)》(2016年第87号)
《关于化学药生物等效性试验实行备案管理的公告》
《总局关于发布人体生物等效性试验豁免指导原则的通告》
《征求胃肠道局部作用药物、电解质平衡用药仿制药质量和疗效一致性评价及特殊药品生物等效性试验申请》
对于临床试验的管理,笔者认为这个草案还有两个不足:一是没有明确规定IV临床试验是否需要申请和审批。二是临床试验用药品的质量管理要求还比较模糊。
欧盟附录13是临床试验中药品质量管理的规范。美国FDA也制定了I期、II期和III期临床试验的药品质量管理指南。而我国目前的《生物等效性研究的统计学指导原则和高变异药物生物等效性研究技术指导原则的通告》还处于草案状态,需要尽快定稿并实施。
各药品注册分类拟重新调整
药品分类一直牵动着药企注册人的神经,因为不同分类的药品注册在信息量、申报流程、耗时、所需资金等方面存在明显差距。本次《高变异药物生物等效性研究技术指导原则的通告》(草案)不仅重新定义了化学药物的分类,而且重新定义了中药制品和生物制品两个类别,显示了修订中药和生物制品注册分类的可能性。
表1:各种药物的注册和分类比较
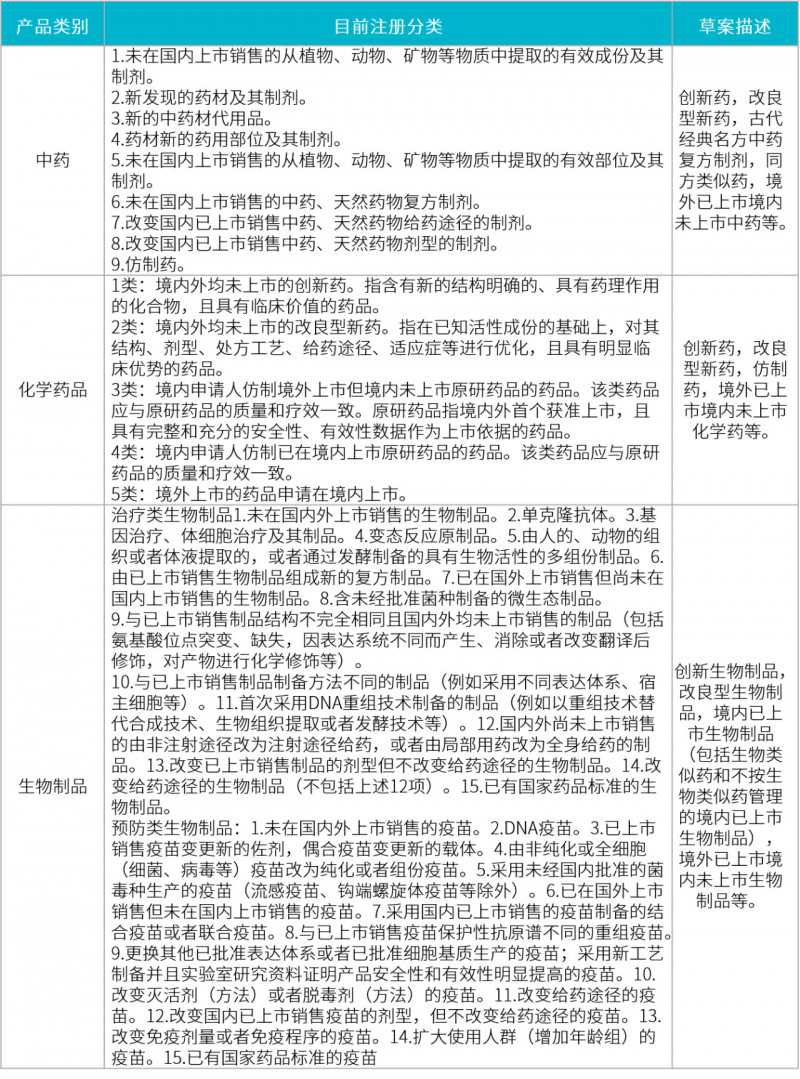
注:草案第5条提供了最新的分类说明。
上述药品分类改革一旦实施,将对药品注册产生巨大影响。笔者分析如下:
中药分类部分
经方的分类在现行法律体系中已有明确规定,此处不再赘述。《临床试验用药物生产质量管理规范》稿提出的同方新同类药,应该是中药注册的新热点。
由于草案只是一个概念,并没有深入的介绍,所以笔者推测,这种处方相同的类似药品,应该是为中药仿制药的申报开辟了一个通道。但由于中药成分复杂,有效成分难以确定。如果单纯按照仿制药来管理,会有更多的困难。同侧相似药概念的引入,估计是参考了生物相似药的一些管理模式,比如要求高度相似的药房,高度标准化的流程,简化一些临床试验要求等。
化学药品部分
现在的分类是经过一次改革后的最新分类,但对部分进口药品不是很适用。举个例子,如果国外的药品是世界上第一个申报的,但是在中国因为属地原因被归为五类化学药品,那就显得有点不匹配了。化学分类的这一调整有望解决这一问题。
生物制品部分
应该说,目前生物制品的分类比较复杂,可以分为治疗性生物制品和预防性生物制品两大类;而且每个大类又分为15个子类,有30个子类之多。
虽然2015年增加了生物相似药物的分类,但是支持文件并不是很详细具体。这次生物制品特别增加了生物类似物和不按生物类似物管理的国内上市生物制品,体现了彻底明确这些分类的意图。
说到生物类似物,欧盟目前的监管体系是最健全的;不仅是整体的监管文件,还有药物研究和非临床与临床研究的指南文件,以及针对不同类型产品的详细的临床试验分类指南。
根据《药品注册管理办法》草案这部分的要求,为了建立关于这部分工作的知识体系,建议药品注册人员学习:
《药品注册管理办法》(2007年修订版)附录1中药和天然药物注册分类和申报资料要求
《药品注册管理办法》(2007年修订版)附录3生物制品的注册和分类及申请资料要求
《药品注册管理办法》(2016年第51号)
《药品注册管理办法》(试行)
《关于发布化学药品注册分类改革工作方案的公告》
《生物类似药研发与评价技术指导原则》
《关于药械组合产品注册有关事宜的通告》(2018年第27号)
《关于调整药械组合产品属性界定有关事项的通告》
注册核查和 GMP 检查的有机结合
谈到这个话题,有必要明确一下过去几年我国药品监管改革中注册核查和GMP认证检查的职责。到目前为止;省级局主要负责GMP认证和企业的日常检查
这个修订草案《关于发布古代经典名方中药复方制剂简化注册审批管理规定的公告》主要集中在第46-51条中的这个问题。关于药品研发现场检查,国务院将根据药品创新程度、药品研究机构以往检查情况和审评需要,决定是否开展药品注册和研发现场检查。
关于现场检查,根据品种、工艺、设施、以往检查情况和审评需要,决定是否启动药品注册现场检查。
应该说这样的规定是合理的。毕竟国家局的资源是有限的,如果对每一个企业、每一种产品都进行一致的检查和管理,实际上是很难做到的。例如,近年来,不少企业反映,其申报的口服仿制药一致性评价未进行现场核查,企业取得了补充申请批准文件;这样做的目的是加强对无菌产品的检查,而淡化对低风险口服药品的现场检查。
此外,第48条和第49条也规定了生产现场检查与GMP检查的关系。目前基本可以确定,GMP认证肯定会被取消。因此,省局和国家局应根据产品和企业风险分类制定相应的检查计划。所以,仍然需要持续合规的运营,是药企生存的必由之路。
根据《中药注册管理补充规定》草案这部分的要求,为了建立关于这部分工作的知识体系,建议药品注册人员学习:
《药品注册管理办法》 GMP术语
《药品注册管理办法》
《药品管理法》
《药品管理法实施条例》
《关于印发药品注册现场核查管理规定的通知》(2019年征求意见稿)
《仿制药一致性评价现场检查-企业指南》(2018年第20号)
《药品注册现场核查管理规定》(2018年第1号)
《关于加强化学仿制药注射剂注册申请现场检查工作的公告》
《关于开展化学仿制药注射剂注册生产现场检查有关事宜的通告》(2017年第77号)
鼓励建立创新渠道。
这次《药品生产企业现场检查风险评定原则》草案最典型的变化就是积极支持创新药注册,明确规定了优先审评的各种特殊序列。
在这个草案中,有四个优先审查顺序:突破性治疗药物程序、有条件批准程序、优先审查批准程序和特殊批准程序。起草人在以下解释中提到,这些优先事项符合国际药品注册制度。使用下表显示这些新内容。
表2:各种优先审查顺序的比较表
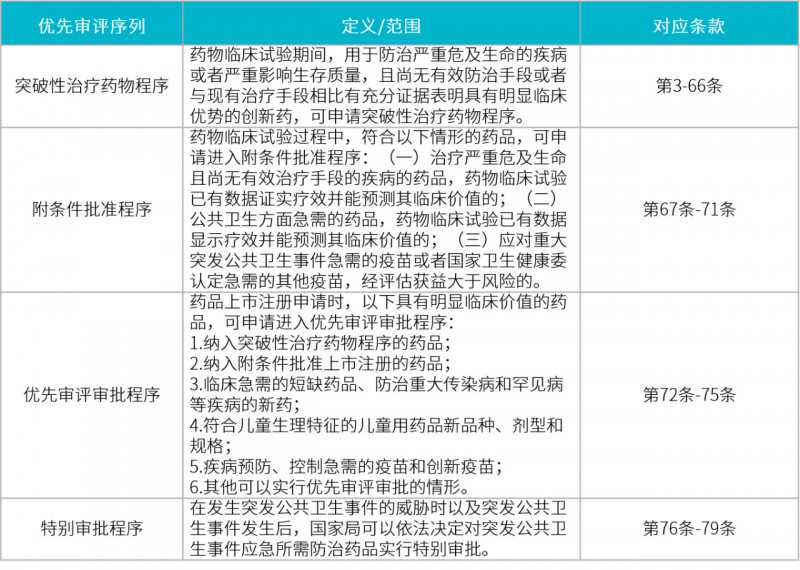
我觉得这个《总局关于发布仿制药质量和疗效一致性评价研制现场核查指导原则等 4 个指导原则的通告》稿在这部分还是有不足的。因为《药品注册管理办法》的意见中提到了三种特殊的注册顺序:特批、特批和优先审核通过。但是,我们可以看到,在这部分特别序列中,并没有关于特别批准的规定的描述。
根据《药品注册管理办法》草案这部分的要求,为了建立关于这部分工作的知识体系,建议药品注册人员学习:
《国家药监局综合司关于《M4:人用药物注册通用技术文档模块一》(局令21号)
《药品注册管理办法》
《国家食品药品监督管理局药品特别审批程序》(美国食品药品监督管理局〔2016〕19号)
《新药注册特殊审批管理规定》
《总局关于解决药品注册申请积压实行优先审评审批的意见》
仍待厘清的某些问题
《关于鼓励药品创新实行优先审评审批的意见》草案虽然已经让药企注册人员看到了明确的工作路径,但也明确了他们未来将面临的更具挑战性的工作。然而,仍有一些问题需要讨论。鉴于作者知识的匮乏,这里尝试提出几点供大家讨论:
一是建议在某条款中明确药品注册文件的语言类别。由于中文是中国的官方语言,建议所有注册文件的正文和关键附件直接用中文声明。
第二,这个《关于临床急需儿童用药申请优先审评审批品种评定基本原则及首批优先审评品种的公告》肯定会对现有的注册制产生根本性的影响。建议明确哪些规定和指导原则无效。但考虑到我国现行药品注册制度的复杂性,估计会在最后加上一句“以前的规定与本办法不一致的,以本办法为准”。
第三,建议在本文件后面增加术语注释,这是国外法律与国内法律法规的明显区别。虽然我国很多药品法律法规都有术语注释,但无论是注释的数量还是内容的严谨性,都有明显的差距。例如,在一些产品的公开审查报告中出现了再加工的术语,但根据中国GMP(2010年修订),只有返工和再加工的定义。此外,留样和稳定性试验样品混用也是中国注册文件中屡犯的错误之一。
第四,中药注册规定与2007年修订版《药品注册管理办法》相似,仍有悬念。比如第124条规定:(对中药的要求)中药的注册申请应当按照本办法的规定办理,其开发和注册管理也应当符合中药的特点。具体要求另行制定。
第五,突破性药物的一些规定仍然不足。根据欧盟突破性治疗药物(ATMP)的特点,分别起草了ATMP的GMP和GCP,以适应这些产品的独特性质。根据最新报告,PIC/S还准备将其GMP附录2一分为二,以反映传统生物制品和ATMP的不同管理要求。希望这部分在修改《药品注册管理办法》时考虑到这个变化。
第六,没有规定临床伦理委员会的作用和工作程序。比如,四期临床试验是否需要伦理委员会的批准,需要明确规定。
参考资料:
1.《药品注册管理办法》于2007年修订
2.2013年修订草案
3.2014年修订草案
4.《药品注册管理办法》 2016年修订草案
5.《药品注册管理办法》 2017年修订的草案
6.《药品注册管理办法》 2019年修订草案