成品/灰色大豆
2015年是特殊的一年。这一年,我国创新药史上最重要的44号文件《国务院关于改革药品医疗器械审评审批制度的意见》出台,随后在2016年改变了新药的定义。2017年6月,ICH正式成为会员。短短三年药监改革带来的监管变化,确实为药企创造了良好的R&D环境。结果也很显著:——推动了2017年以来新药审批的快速增长。五年来,研发难度最高的一类新药占比从2016年的不到30%上升到2020年的50%左右。
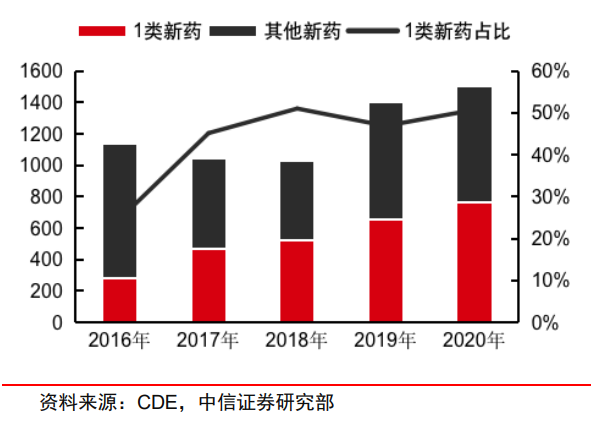
CDE1新药申请数量(单位:个)
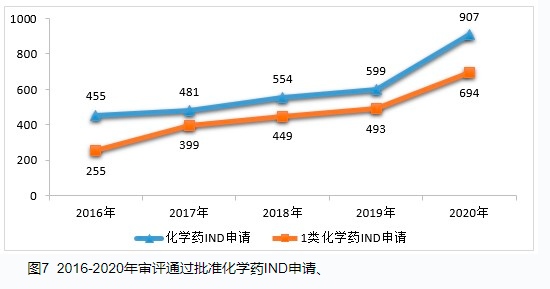
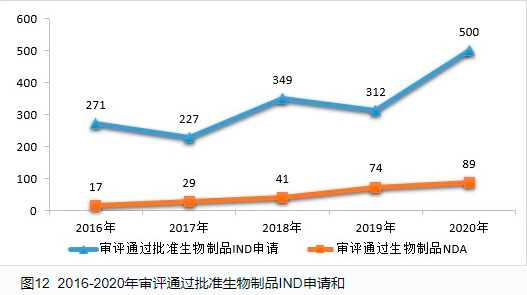
2019年开始带量采购,2020年伴随着新冠肺炎疫情,很多特殊政策也加速出现。直到今年7月2日公布的讨论稿,才表明了以临床价值为中心的临床设计的观点。这些变化与我们临床试验的基本准则GCP的指导密切相关。结合张丹院士现场讲座内容,本文整理如下:课程PPT将由GCP微信号领取。
01 GCP的历史
GCP(Good Clinical Practice)是规范药物临床试验全过程的标准法规,包括方案设计、组织实施、监督、检查、记录、分析、总结和报告。其目的是保证临床试验设计和过程的规范化,使结果科学可靠,保护受试者的权益,确保其安全性。它是ICH系列指南中最基本、最关键的指南。
GCP不仅适用于承担各期(-期)临床试验的人员(包括医院管理人员、伦理委员会成员、各研究领域的专家、教授、医生、药师、技术人员和化验员),也适用于药品监督管理人员、医药企业临床研究人员及相关人员。

在GCP出现之前,研究人员滥用受试者的现象是有争议的。1964年在芬兰举行的第18届世界医学大会上,《赫尔辛基宣言》被正式通过,正式声明医生的首要职责是保护受试者的生命和安全。事实上,即使是药物上市前必须进行的安全性临床试验,也是通过惨痛的教训建立起来的。比如著名的“反应停事件”,就是由于药物临床试验缺乏严格的管理,导致成千上万的畸形胎儿出生,新生儿死亡。
自美国FDA以来,其他国家的药品管理部门也纷纷效仿,颁布了自己的GCP。但虽然基本原则一致,但具体细节不同,导致无法互认的情况。经过一系列发展,1996年5月,国际人用药物注册技术要求协调会议(ICH)颁布了ICH GCP指南,该指南涵盖了药物注册质量、安全性和有效性的技术要求,代表了临床试验的最新国际标准,得到了世界各国的广泛重视和认可。
中国引进、推广和实施GCP已近十年。
自1986年以来,中国一直在了解国际GCP的发展情况。1992年,他派工作人员出席了世卫组织GCP准则的最后会议;1993年,收集了各国的GCP准则,并邀请外国专家来华介绍GCP在国外的实施情况。1994年,GCP研讨会召开,中国GCP规范的起草工作开始。1995年,成立了由5位临床药理学专家组成的起草组,起草了中国《药品临床试验管理规范》(送审稿),开始在全国范围内开展GCP知识的培训。1998年3月2日,卫生部颁布《药物临床试验管理规范》(试行);国家医药产品管理局成立后,对该规范进行了进一步的讨论和修改,并于1999年9月1日由国家医药产品管理局正式颁布实施。
02 GCP的现行版本

更正:2019年R3,此处PPT错误。
自1996年发布第一版以来,临床试验的复杂程度和规模发生了很大变化,并且由于新技术的引入和风险过程的变化,ICH正在考虑制定第二版指南,以补充第一版,使其更符合当前的临床情况。2015年,R2版本草案发布,并于2017年正式通过。中国于2020年7月1日开始实施R2版标准。
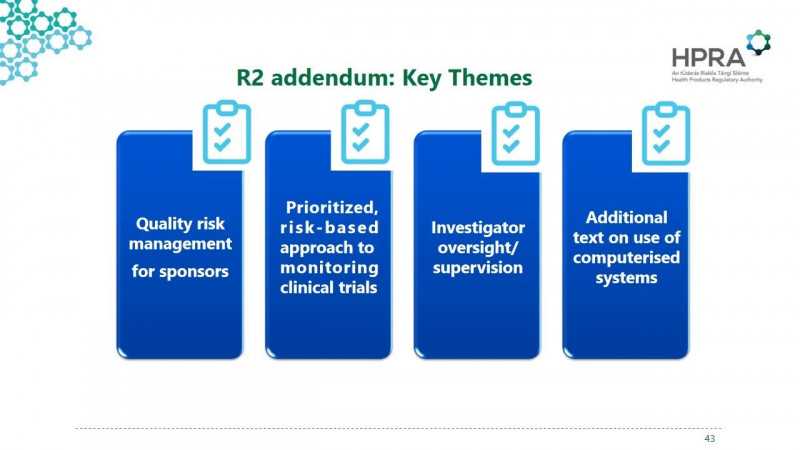
R2的主要变化体现在以上四个方面。现在我们简单梳理一下——。
风险管理:
质量风险管理。在过去,总是有一种一刀切的方法,但我们都知道,不同的产品有自己独特的风险因素。要具体问题具体分析,比如脑瘤和皮肤的危险因素不一样。现在逐渐转变为根据临床试验的特点和风险因素设计有针对性的质量管理体系,并根据预期可能的结果对现有的试验流程进行修正。在换成SOP的过程中,一定要对自己的临床试验流程有深刻的了解。
临床试验风险。首先,成分有大分子和小分子,活性成分的活性程度不同,会导致不同的危险因素。二是临床设计,包括临床设计的复杂程度、目标人群、临床试验的规模、伴随诊断、对特殊受试者的保护等带来的风险差异。最后,即使前面已经纠正了各种潜在的风险因素,但实施过程中涉及人员和环境的差异也会带来风险。
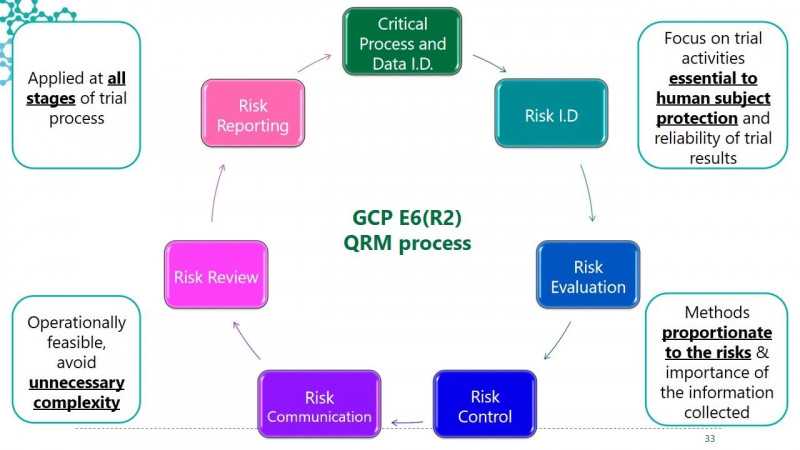
质量风险管理贯穿整个过程。
基于风险的监控:
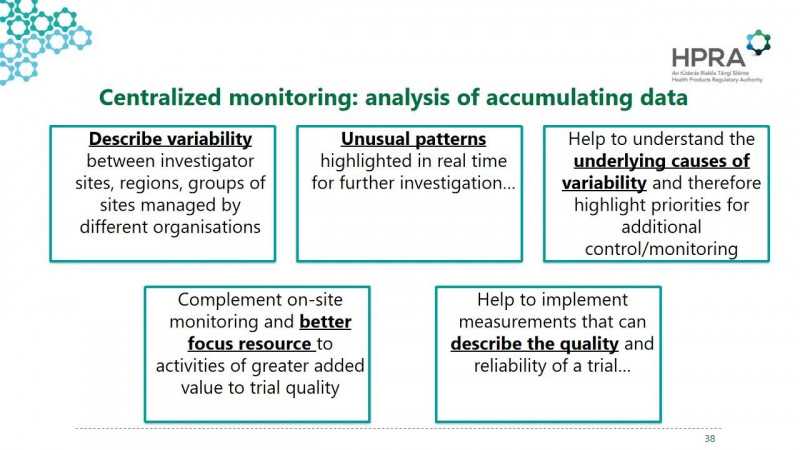
传统的监测依赖于PI和CRA的关系,侧重于原始数据的验证,对高风险的临床试验给予更严格的检查。问题的调查主要依靠督察员的报告,纠正问题的效率较低。
R2提出了中央监控的概念。通过大数据的实时分析,可以更好地将监测资源定向到最需要的地方,既能有效利用资源,又能提高临床试验的质量。事实上,它允许灵活的监控方法相互结合,以更好地适应当前的情况。
PI的职责:
现在的研究情况更加复杂,涉及的部门越来越多。比如有些实验需要第三方实验室和特殊的实验环境。PI应对其找到的供应商和服务提供商负责,使其符合GCP的要求,并确保其服务提供商的专业性。如果他们不合格,PI也应该为此承担一定的责任。

电子信息系统:
随着信息技术的发展,R2版本也考虑到云计算,包括数据处理硬件,数据采集软件,和电子病历。

数据应是可归属的、合法的、同期的、原始的、准确的和完整的,以便支持准确的描述报告和分析测试。要符合数据,就要符合规定的原则,比如ALCOAC,但对输出数据的仪器没有要求。
事实上,R2版本也考虑了电子数据的风险,因此引入了风险评估。这就需要主办方在做电子系统评估和电子系统认证时,建立自己的SOP来规范使用流程。

从R2版本的实施情况来看,可以说R2版本已经被ICH的监管成员国普遍接受。这种广泛采用的标准化临床试验有助于数据的相互认可,目的是避免科学上不合理的重复试验。
2017年ICH发布GCPR2时,第三版起草委员会成立,GCP迎来了品质源于设计的新革命。
03 GCP的新改变
R3版仍然保留了基于风险的各种措施和手段,并思考了新的临床试验环境、新的数据来源以及可以收集的数据的多样性。
基本原则的修订分为两步。第一部分仅考虑与R2版本相关的常规临床试验,主要是更新和完善第二版本。第二部分主要讨论非常规干预试验。
