21世纪是生命科学的世纪。目前,美国科学院院士中有一半以上从事生命科学领域的研究。美国联邦政府资助科研的预算中,超过一半用于生命科学研究。因此,与化学药物相比,生物药物在治疗人类疾病方面发展越来越快。
生物药物简称生物药,主要分为重组蛋白药物、重组多肽药物、重组DNA药物和干细胞治疗药物。预计2022年全球生物制药市场规模将达到3260亿美元。同时,FrostSullivan预测,2021年中国生物制药市场规模将达到3269亿元。回顾2018年,全球共有93种新药上市。其中化学药物54种,生物药物39种。
首先,我们来综合一下这39种药物的靶点和R&D信息:
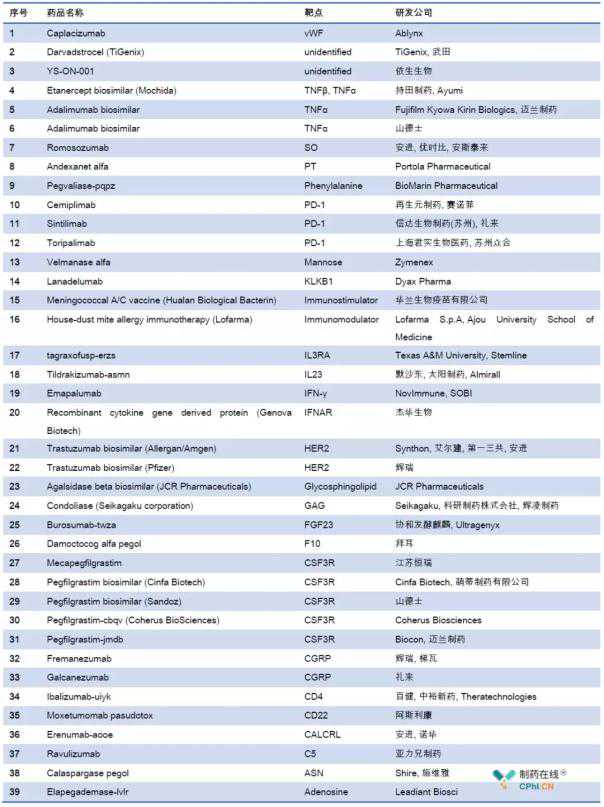
1.卡普拉西单抗
Ablynx研发的Caplacizumab于2018年8月31日获得EMA批准上市,商品名为Cablivi。这是一种针对血管性血友病因子的纳米抗体,已被批准用于治疗获得性血栓性血小板减少性紫癜(TTP)。
2.达尔瓦德斯特罗塞尔
Darstrocel于2018年3月23日获得EMA批准上市,商品名为Alofisel。它是一种脂肪细胞同种异体替代疗法,含有从脂肪中提取的人类同种异体间充质干细胞。该产品被批准用于治疗肛门直肠瘘。
3.001号河畔YS
YS-ON-001由益生生物开发并以伊维卡的商品名销售。2018年批准在柬埔寨销售,用于治疗乳腺癌、结直肠癌、肝癌、肺癌、胃癌等实体瘤。
4.依那西普生物仿制药
由知天药业股份有限公司研发的生物类似物依那西普于2018年1月19日获得PMDA批准上市。依那西普是一种肿瘤坏死因子(TNF)阻断剂,能特异性结合TNF分子,抑制TNF-和TNF-与细胞表面TNF受体的结合。该药物可用于治疗类风湿性关节炎和幼年特发性关节炎。
5.阿达木单抗生物仿制药
胡里奥
FKB-327由富士协和麒麟生物公司研发,并于2018年10月获得EMA批准上市。它的商品名是胡里奥。它是靶向肿瘤坏死因子的人IgG1阿达木单抗的生物类似物,并被批准用于治疗类风湿性关节炎、强直性脊柱炎、银屑病关节炎、银屑病、化脓性汗腺炎症、克罗恩病、溃疡性结肠炎、葡萄膜炎、幼年类风湿性关节炎和斑块型银屑病。
6.阿达木单抗生物仿制药
阿达木单抗的生物类似物Hefiya于2018年7月26日获得EMA批准上市。它是由山德士公司开发和销售的。它是一种肿瘤坏死因子(TNF)抑制剂,被批准用于治疗脊柱关节炎、葡萄膜炎、化脓性汗腺炎症、银屑病、幼年特发性关节炎、银屑病关节炎、丘疹鳞屑性皮肤病、克罗恩氏病等。
7.Romosozumab
Romosozumab于2018年1月获得EMA批准上市,商品名为Evenity。
这是一种针对硬化素的单克隆抗体,已被批准用于治疗具有高骨折风险的绝经女性和男性的骨质疏松症。
8.安德克萨内特阿尔法
Portola Pharmaceutical研发的Andexanet alfa已于2018年5月3日获得FDA批准上市,商品名为Andexxa。它是一种重组修饰的凝血因子Xa,能与凝血因子Xa的抑制剂利伐沙班和阿哌沙班结合,从而发挥促凝作用。该药物被批准用于接受利伐沙班和阿哌沙班治疗的有生命危险或无法控制出血的患者的反向抗凝治疗。
9.Pegvaliase-pqpz
Pegvaliase-pqpz于2018年5月24日获得FDA批准上市,商品名为Palynziq。它是一种重组苯丙氨酸代谢酶,与N-羟基琥珀酰亚胺(NHS)-甲氧基聚乙二醇(PEG)偶联,能将苯丙氨酸转化为氨和反式肉桂酸。本品可用于降低苯丙酮尿症患者(血苯丙氨酸浓度超过600 mol/L)的血苯丙氨酸浓度。
10.Cemiplimab
Cemiplimab于2018年9月28日获得FDA批准上市,商品名为Libtayo。它是一种抗PD-1的单克隆抗体,被批准用于治疗转移性皮肤鳞状细胞癌(CSCC)或不能接受治愈性手术或放疗的局部晚期CSCC患者。
11.Sintilimab sindilizumab
地利珠单抗(IBI-308)是信达生物开发的PD-1。它于2018年12月27日由NMPA批准,用于治疗至少二线全身化疗后复发或难治的经典型霍奇金淋巴瘤,商品名为Tyvyt。此外,对晚期或转移性鳞状非小细胞肺癌、胃和胃食管结合部腺癌的治疗研究现已进入临床三期。
12.托里帕利单抗
Tereplizumab (JS001)的商品名是易拓。2018年12月17日,曲普利单抗注射液上市申请获得NMPA批准,成为首个在中国上市的中国自主研发的PD-1单克隆抗体。是由上海君实生物医药科技有限公司和苏州众合生物医药科技有限公司(君实生物子公司)合作研发的人源化单克隆抗体。它以程序性死亡受体1(PD-1)为靶点,用于治疗过去未接受系统性治疗的不可切除或转移性黑色素瘤患者。它旨在用于治疗乳腺癌、淋巴瘤、恶性黑色素瘤、泌尿生殖器癌和其他种类的实体瘤。
13.费尔马纳塞阿尔法
由Zymenex(Chiesi Farmaceutici的子公司)开发的Velmanase alfa于2018年3月23日获得EMA批准上市,其商品名为Lamzede。它是一种重组-甘露糖苷酶,可以补充或替代天然-甘露糖苷酶,减少甘露糖的积累。该药物被批准用于治疗轻度至中度甘露糖苷储存。
14.Lanadelumab
Lanadelumab于2018年8月23日获得FDA批准上市,商品名为Takhzyro。它是一种靶向血浆激肽释放酶(pKal)的人单克隆IgG1抗体,用于预防12岁及以上遗传性血管性水肿(HAE)患者的血管性水肿发作。
15.脑膜炎球菌A/C疫苗
华生物疫苗研发的A、C群脑膜炎球菌疫苗(脑膜炎球菌A/C疫苗)于2018年3月20日获得批准上市。A群和C群脑膜炎球菌疫苗被批准用于预防由A群和C群脑膜炎球菌引起的流行性脑脊髓膜炎。
16.室内尘螨过敏免疫疗法
洛法玛研发的屋尘螨过敏性免疫疗法于2018年获批上市,商品名为Laismetes舌下含片。它是一种免疫疗法,被批准用于治疗过敏性哮喘、鼻炎和鼻结膜炎。
17.tagraxofusp-erzs
Tagraxofusp-erzs于2018年12月获得FDA批准上市,商品名为Elzonris。这种药物是一种以CD123为靶点的细胞毒药物,是白细胞介素-3与白喉毒素的部分片段形成的重组融合蛋白。该药物被批准用于治疗成人和2岁以上儿童的急性浆细胞样树突状细胞肿瘤(BPDCN)。
18.Tildrakizumab-asmn
Tildrakizumab-asmn于2018年3月20日获得FDA批准上市,随后于2018年9月17日获得EMA批准上市。Ilumya是一种人源化IgG1单克隆抗体,靶向白细胞介素23(IL-23)的p19亚单位,可以阻断p19亚单位与白细胞介素23(IL-23)受体之间的相互作用。这种药物被批准用于治疗成人中度至重度斑块型银屑病。
19.Emapalumab
Emapalumab单克隆抗体已于2018年11月20日获得FDA批准上市。该药物由Novimmune SA公司开发和销售,其商品名为Gamifant。它是一种靶向干扰素-(IFN-)的人单克隆抗体,已被批准用于治疗成人或婴儿原发性噬血细胞性淋巴组织细胞增多症(HLH)。
20.重组细胞因子基因衍生蛋白
该产品由杰华生物研发,于2018年4月12日获得NMPA批准上市。它的商品名是novaferon。它是一种重组细胞因子基因衍生蛋白,其结构与天然序列的干扰素有很大不同。能抑制病毒复制,增强抗病毒免疫力,同时增强自身免疫力,抑制肿瘤细胞增殖和肿瘤血管生长,从而阻断肿瘤血供。可用于治疗慢性乙型肝炎
21.曲妥珠单抗生物仿制药
Kanjinti于2018年5月16日获得EMA批准上市,PMDA于2018年9月21日获得批准上市。本品为曲妥珠单抗的生物类似物,即针对HER2的人源化IgG1单克隆抗体,用于治疗HER2早期乳腺癌和胃癌。
22.曲妥珠单抗生物仿制药
曲妥珠单抗的生物类似物Trazimera由辉瑞公司开发,并于2018年7月26日获得EMA批准上市。它是一种人源化IgG1单克隆抗体,结合肿瘤细胞上的HER2并介导抗体依赖性细胞毒性(ADCC)。该药物可用于治疗HER2过表达的乳腺癌、HER2过表达的转移性胃癌或食管胃结合部腺癌。
23.琼脂糖酶生物类似物
JCR Pharmaceuticals研发的agasaccharase 生物仿制药于2018年9月21日获得PMDA批准上市。半乳糖苷酶是一种重组半乳糖苷酶,已被批准用于治疗法布里病。
24.康多里酶
Condoliase由生化工业股份有限公司研发,并于2018年3月获得PMDA批准上市。它的商品名是Hernicore。它是一种糖胺聚糖降解酶,能诱导椎间盘组织中的软骨素-6硫酸化蛋白聚糖溶解。该产品被批准用于治疗椎间盘移位。
25.Burosumab-twza
Burosumab-twza最初由Kyowa Hakko Kirin开发,于2018年2月19日获得EMA批准,并于2018年4月17日获得FDA批准上市。它的商品名是Crysvita。它是一种靶向成纤维细胞生长因子23(FGF23)的人IgG1型单克隆抗体,并被批准用于治疗X连锁低磷酸盐血症(XLH)。这是首个被批准用于治疗1岁及以上儿童和成人X连锁低磷血症(XLH)的孤儿药。
26.达摩考格阿尔法派戈尔
Jivi(达莫科格聚乙二醇)是由拜耳公司开发的重组人凝血因子。2018年8月29日获得FDA批准上市。Jivi是一种重组因子VIII(rFVIII)替代疗法,可以替代凝血过程中缺失的凝血因子VIII。Jivi被批准用于以前治疗过的成人和青少年(12岁及以上)血友病A,用于按需治疗和控制出血事件;围手术期出血;常规预防以减少出血发作的频率。
27.Mecapegfilgrastim
江苏恒瑞的噻吩甲酸已于2018年5月8日获得NMPA批准上市,商品名为爱多。本品为聚乙二醇化重组粒细胞集落刺激因子,用于化疗引起的中性粒细胞减少症。
28.Pegfilgrastim生物仿制药(Cinfa Biotech)
Pefegelastine生物仿制药(Cinfa Biotech)于2018年11月20日获得EMA批准上市。它的商品名是Pelmeg。它是以聚乙二醇化重组粒细胞集落刺激因子为活性成分的皮下注射液。用于治疗化疗引起的中性粒细胞减少症和预防发热性中性粒细胞减少症。
29.Pegfilgrastim生物仿制药
Zioxtenzo是由诺华公司的子公司Sandoz开发的一种pegfilgrastim生物类似物。这种药物于2018年12月获准在英国上市。它是一种聚乙二醇化的重组人粒细胞集落刺激因子,能调节骨髓中性粒细胞的产生,影响中性粒细胞前体细胞的增殖、分化和功能。该药物可用于治疗非髓系恶性肿瘤患者的发热性中性粒细胞减少症。
30.Pegfilgrastim-cbqv
Pegfilgrastim-cbqv由Coherus Biosciences开发,2018年11月2日通过FDA批准,随后于2018年9月21日通过EMA批准。它的商品名是Udenyca。是一种聚乙二醇化重组粒细胞集落刺激因子,用于治疗化疗引起的中性粒细胞减少症。
31.Pegfilgrastim-jmdb
Pegfilgrastim-jmdb已于2018年6月4日获得FDA批准上市,商品名为Fulphila。
Pegfilgrastim-jmdb是Pegfilgrastim的生物类似物,即重组甲硫氨酸人粒细胞集落刺激因子(G-CSF)和单甲氧基聚乙二醇的共价缀合物。该产品可用于治疗抑制骨髓的抗癌药物引起的发热性中性粒细胞减少症。
32.Fremanezumab
Fremanezumab于2018年9月14日获得FDA批准上市,商品名为Ajovy。它是一种靶向降钙素基因相关肽(CGRP)的人源化IgG2单克隆抗体,已被批准用于治疗成人偏头痛。
33.Galcanezumab
Lili公司研发的Galcanezumab于2018年9月27日获得FDA批准上市。它的商品名是Emgality。这是一种靶向降钙素基因相关肽(CGRP)的人源化单克隆抗体,已被批准用于治疗成年患者的偏头痛。
34.Ibalizumab-uiyk
Lizumab-UIYK于2018年3月6日首次获得FDA批准,商品名为Trogarzo。它是人源化的IgG4单克隆抗体,通过结合CD4的结构域2,干扰HIV-1入侵宿主细胞的过程,阻止HIV-1感染CD4 T细胞。这种药物的批准适应症是成人HIV-1病毒感染,包括接受过多重抗HIV-1治疗方案、对其他抗逆转录病毒药物具有耐药性以及在当前抗逆转录病毒治疗中失败的患者。
35.Moxetumomab pasudotox
AZ公司研发的Moxetumomab pasudotox于2018年9月13日获得FDA批准上市,商品名为Lumoxiti。它是一种重组CD22靶向抗毒素,被批准用于治疗毛细胞白血病。
36.埃伦玛布-奥勒
Erenumab-aooe已于2018年5月17日获得FDA批准上市,商品名为Aimovig。它是一种针对降钙素基因相关肽(CGRP)受体的人IgG2型单克隆抗体。这种药物被批准用于预防和治疗成人偏头痛。
37.Ravulizumab
由Alexion Pharma开发的Ravulizumab于2018年12月21日获得FDA批准上市,商品名为Ultomiris。它是一种靶向补体蛋白C5的人源化单克隆抗体,是治疗阵发性睡眠性血红蛋白尿症的孤儿药。
38.卡拉斯帕尔酶
Calaspargase pegol于2018年12月获得FDA批准上市,商品名为Asparlas。该药为天冬酰胺特异性酶,可将L-天冬酰胺催化为天冬氨酸和氨,被批准为儿童和成人淋巴细胞白血病多药化疗的辅助药物。天冬氨酸的药理作用是基于消除血浆中的L-天冬酰胺,从而杀死白血病细胞。
39.Elapegademase-lvlr
Elapegademase-lvlr由Leadiant Biosci开发,于2018年10月5日获得FDA批准上市。其商品名为Revcovi,是一种重组腺苷脱氨酶,用于治疗免疫缺陷儿童和成人的ADA缺乏症(ADA-SCID)。
生物制药在整个医药行业的发展方兴未艾,越来越多的公司积极从事生物制药的研究。与此同时,中国的生物创新与欧美国家相比还比较落后,国内生物医药的大部分市场份额仍被外资企业的产品占据和主导。据IMS Health预测,到2020年,中国生物医药市场将成为仅次于美国的全球第二大生物医药市场。那么这个过程中的风口在哪里呢?怎样才能飞得更高?下一个分解~