8月25日,FDA批准了第二个仿制药Humira(阿达木单抗)F,来自勃林格殷格翰的Cyltezo(阿达木单抗-adbm,40 mg/0.8 mL)。批准的适应症包括中度至重度活动性类风湿性关节炎、活动性银屑病关节炎、活动性强直性脊柱炎、中度至重度活动性克罗恩病和成人溃疡性结肠炎、中度至重度斑块型银屑病和4岁以上青少年多关节幼年特发性关节炎。
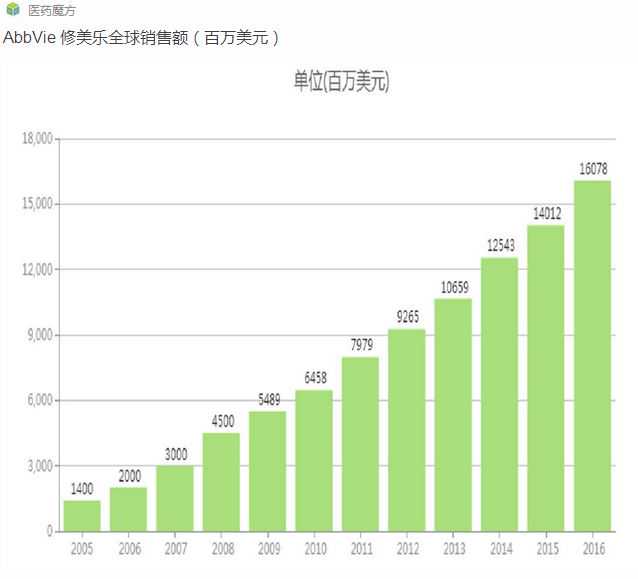
Humira是世界上第一个上市的抗TNF-药物。自2002年首次获得FDA批准以来,它已经积累了近1000亿美元的销售收入,甚至在今天还创下了单个药物每年两位数增长的年度销售新纪录。humira 2016年全球销售额为160.78亿美元,今年上半年销售额为88.34亿美元,预计2017年将达到180亿美元。
Amjevita的Amjevita(adalimumab-atto)是Humira第一个获得FDA批准的仿制药,早在2016年9月23日就获得批准。然而,由于艾伯维与Amjevita之间的专利诉讼尚未解决,Amjevita目前尚未在美国上市销售。8月初,勃林格殷格翰也被艾伯维起诉(见:为Humira辩护,艾伯维指控勃林格殷格翰专利侵权),被指控侵犯了Humira的74项专利。因此,勃林格殷格翰短期内应该不会上市出售Cyltezo。
由于有100多项专利的保护,Humira并没有受到生物类似物的打击,今年上半年在美国市场的销售额丝毫没有受到影响,还增长了20%(58.97亿美元)。艾伯维甚至自信其专利保护期可以持续到2022年。
然而,随着仿制药公司的冲击和诉讼数量的大幅增加,艾伯维和美国专利商标局将面临越来越大的压力。花旗银行(Citibank)分析师安德鲁鲍姆(Andrew Baum)表示:“阿达木单抗类似物上市的时间将快于艾伯维的预期。预计Humira的销售额将在2018年达到峰值,然后开始下降,2022年将降至约60亿美元”。
