在疫情全球蔓延的紧急形势下,各国监管机构纷纷简化新冠肺炎的申请程序,加快相关检测产品在新冠肺炎的上市速度。
但是非新冠肺炎测试呢?据悉,由于考点关闭或团内患者减少,大量R&D计划按下了暂停键。截至4月3日,辉瑞、BMS、礼来等大型跨国制药公司,以及包括Moderna Therapeutics、伊维生物在内的生物技术公司都公开宣布修改其R&D计划。
全球临床试验危机不言而喻。根据生命行业市场咨询公司evaluate的子公司华帝公司的一项计算,预计将有315项临床试验研究因疫情而推迟。这些研究原定于今年年底到期,涉及超过17万名受试者,涉及金额可能高达200亿美元。
几天前,Medidata数据库调查并分析了全球182,227个研究地点的4,600项“活跃”临床研究。结果显示,与去年同期相比,今年3月新招募的患者数量下降了65%,4月的前两周继续下降至75%。

从这份调查中不难发现,新冠肺炎疫情导致全球大部分国家的患者入组人数较去年同期大幅下降。具体来看,在4月的前两周,只有中国、韩国和意大利的患者报名人数呈下降趋势,其他国家的患者报名人数在疫情影响下继续扩大,其中印度和英国分别呈96%和98%的下降趋势。
细分层面,肿瘤药物试验受影响相对较小,2020年4月前两周同比下降51%,但心血管和皮肤科药物研究受影响尤为明显,同比分别下降95%和90%。
在此背景下,有什么策略可以缓解新冠肺炎疫情引发的全球临床试验危机?4月27日,Parexel国际公司全球临床运营副总裁Jenny Gidley和公司副总裁Alberto Grignolo在文章《Five strategies for mitigating the impact of COVID-19 on clinical trials》中提出,虚拟试验(使用数字医疗技术并允许患者在家参与)和混合试验(结合随机盲对照试验和真实世界数据)的速度、效率和成本节约可能会永久改变临床试验的前景。此外,他们还提出了应对当前临床试验危机的五大策略:
1、通过远程监控确保患者安全
药物开发的首要任务是患者安全。然而,在当前的环境下,大多数临床研究人员无法按照传统的监测方法去现场审查、验证和讨论研究数据,并且一些以前在现场完成的工作现在必须以结构化的方式通过电话或电子通信远程完成。这是一个巨大的变化,也是对项目方和监管者的重大挑战。
为了应对新冠肺炎时代社会距离带来的临床试验安全挑战,该行业迅速转向远程解决方案。例如,Parexel正在探索远程访问源文档的新方法,研究人员试图通过电话或视频等远程方式与患者互动。如果患者不能到达现场,他将直接把临床试验资料(如果可能的话,包括研究药物)寄给患者。
当然,虽然可以远程保护患者的安全,但是需要根据试验的患者群体、方案、地理位置等因素定制解决方案。
此外,如果研究人员不能根据协议进行研究,或完全信任地监控患者安全,他们将需要暂停研究,停止注册或暂停参与者。此时,站点可以重点关注已入组研究的患者的安全性,并保持治疗的连续性。
2、在出现新风险时采取新的风险评估方法
目前,试验主办方正在试图评估新冠肺炎可能直接影响研究参与者的风险(例如,如果他们感染了疾病),以及新冠肺炎相关措施(如社会距离)是否会影响试验。
这是一个非常微妙的过程。要评估每个国家每个试验中每个患者的每个问题,需要高度关注细节,专业知识深厚,也增加了费用。对于新冠肺炎疫情的新风险评估问题,几乎没有通用的答案,但一些变通方法在大多数临床试验中是有效的,甚至在一些设计复杂的试验中也是如此。
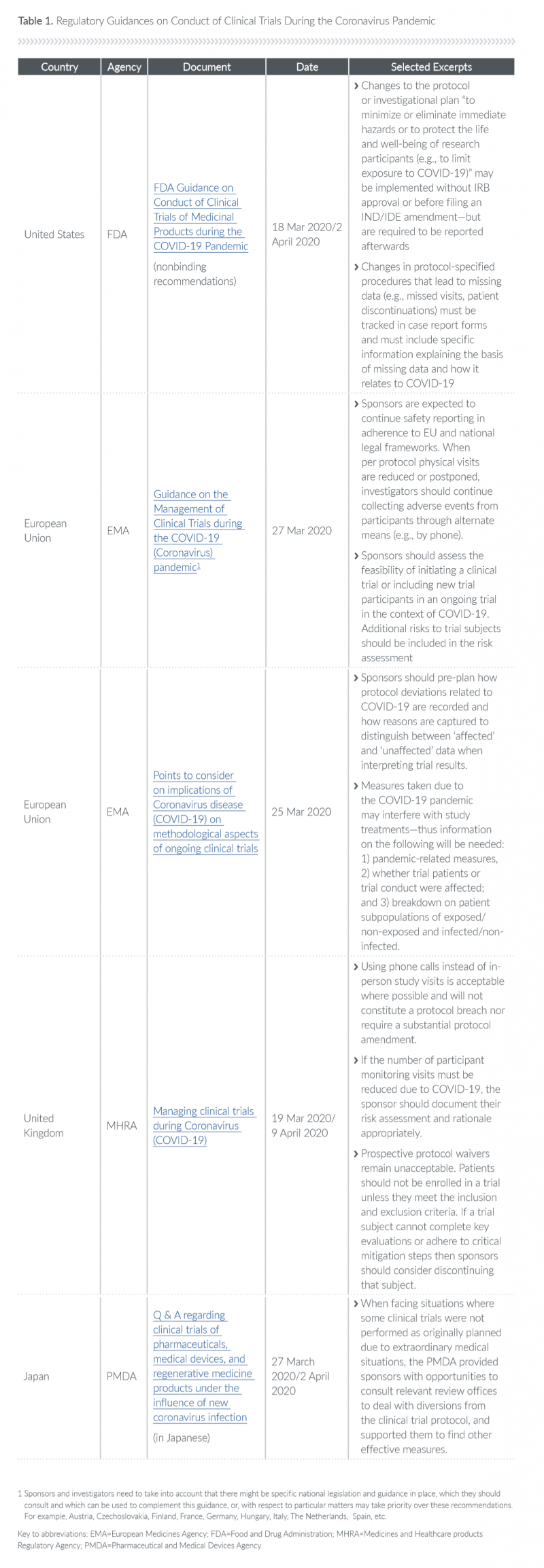
最近的欧盟新冠肺炎指导文件(详见文末表格)要求每项试验的申办者实施新冠肺炎驱动的获益风险评估和风险缓解措施,其中获益风险评估应包括:
新冠肺炎疫情对参与者造成的额外风险,以及采取的风险缓解措施;
如何权衡参与试验的风险(新冠肺炎因素)与参与者和社会的预期收益。如果这两种情况发生冲突,受试者的安全应始终优先;
记录相关方的输入(例如,医疗监护人的输入),优先考虑临床试验中的关键任务以及如何最好地执行这些任务;
为正在进行的临床试验积累专业知识,找到全面风险评估的带宽,应该是当今试验申办者的首要任务。
3、与监管机构保持沟通
一旦制定了风险缓解策略或进行了临床试验变更的风险评估,项目方必须通过任何可能的方式(包括电子邮件或电话)通知监管机构,并向其披露发现的潜在问题。
如今,开发新冠肺炎疫苗和治疗药物已成为全球优先事项。FDA优先考虑新冠肺炎相关产品的提交。为了实现这一目标,他们正在从不太繁忙的地区重新部署员工,或者重新部署具有新冠肺炎处理经验的人员。虽然目前的重新部署没有推迟审查活动,但推迟仍然是现实的可能性。
在欧盟,面对面的会议不再常见,通过电话和邮件与监管机构互动并征求他们的意见变得越来越重要。然而,数据的电子传输并没有被广泛接受:在一些欧洲国家是可能的,但在另一些国家则不可能。
在实施之前与监管者讨论是关键。FDA在一系列问题上表现出了非凡的灵活性,从项目方如何记录知情同意,到虚拟临床试验,再到在上市申请中使用真实世界的证据。如果一个前所未有的解决方案能够满足监管部门的要求,以及患者和项目方的需求,那么监管部门可能会比过去更加开放。
尽管监管机构永远不会在患者安全或GCP兼容数据的有效性上妥协,但现在在如何和何时收集数据(例如,终点可以延迟)、如何进行研究监测以及如何向患者提供研究药物方面有了灵活性。监管机构需要了解赞助商可能想要尝试的任何解决方案,企业可以通过有效的沟通来保护他们的药物开发计划。
4、在特殊情况下保持数据的完整性
在试验主办方不得不修改研究计划以应对新冠肺炎疫情的情况下,监管部门希望有详细的偏差记录以保持试验数据的完整性和可解释性。
世界各地的监管机构表示,他们将比过去更加灵活。例如,上述FDA指南规定,对方案或研究计划的更改旨在“最小化、消除直接危害,或保护研究参与者的生命和健康(如限制暴露于新冠肺炎)。”它可以在IRB批准或IND/IDE修订提交之前实施,但必须在之后报告。"
认识到疫情造成的损害可能导致丢失数据的增加,FDA要求病例报告表必须跟踪丢失患者的退出和方案指定程序中的类似变化,并且必须包括解释丢失数据和新冠肺炎疫情之间关系的具体信息。
EMA(欧盟管理局)鼓励项目方“提前计划”如何记录与新冠肺炎相关的程序偏差以及获取丢失数据的原因,以便在解释测试结果时区分“受影响”和“未受影响”的数据。尽管EMA发布了欧盟的一般指南,但欧盟成员国的国家监管机构直接负责这些试验。因此,试验申办者需要检查特定国家的指导文件。
5、对不断变化的法规保持警惕,保持参与
项目方需要跟踪其进行临床试验的地方当局和监管机构发布的不断变化的新冠肺炎指南。旅行限制的严格程度、对社交距离的要求、封锁和隔离规则以及对检测和接触者追踪的要求因地区而异。
在新冠肺炎疫情事件平息之前,大量的临床试验(虽然不是全部)将不可避免地暂停,但项目方应该继续参与。在这方面,Parexel目前正在向客户提供大量的监督服务,当客户的暂停试验恢复时,他们将获得所有信息。
简而言之,跟踪监管指导和评估不同机构的灵活性将是在当前暂时中断的药物开发环境中生存的关键。
结语:变化是常态
这场危机不会永远持续下去。只有现在做好准备,接下来的研究才能更有效的重新开始。
在文章的最后,作者认为,这次突发公共卫生事件可能会永远改变临床试验。目前,行业和监管机构正在努力探索新的临床试验方法,并评估疫情那些“更虚拟和分散”的试验方法。如果这些新方法在疫情期间被证明是有效的,监管当局可能会在未来继续使用它们。
在不久的将来,当新型冠状病毒成为历史时,但在这个疫情中,虚拟试验和混合试验将是典型的研究设计,或者它将更好地惠及患者。
附:新冠肺炎疫情期间药物临床试验的FDA指南(非约束性建议)