今天,Immunocore宣布,FDA已批准其创新疗法Kimmtrak(tebentafusp-tebn)用于治疗特定的葡萄膜黑色素瘤。新闻稿指出,这一批准创下了多个第一:这是FDA批准的第一个用于不可切除或转移性葡萄膜黑色素瘤的治疗方法。它也是第一个监管批准的T细胞受体(TCR)疗法,以及第一个FDA批准的用于治疗实体肿瘤的双特异性T细胞连接器。
作为一种创新的双特异性蛋白,Kimmtrak由两部分融合而成:一端是具有高亲和力的可溶性T细胞受体,另一端是针对CD3的免疫效应结构域。这种疗法可以特异性地靶向gp100,一种在黑素细胞和黑色素瘤中表达的抗原。此前,这种“一流”疗法已被FDA认定为突破性疗法、快速通道资格、孤儿药资格和优先评估资格。
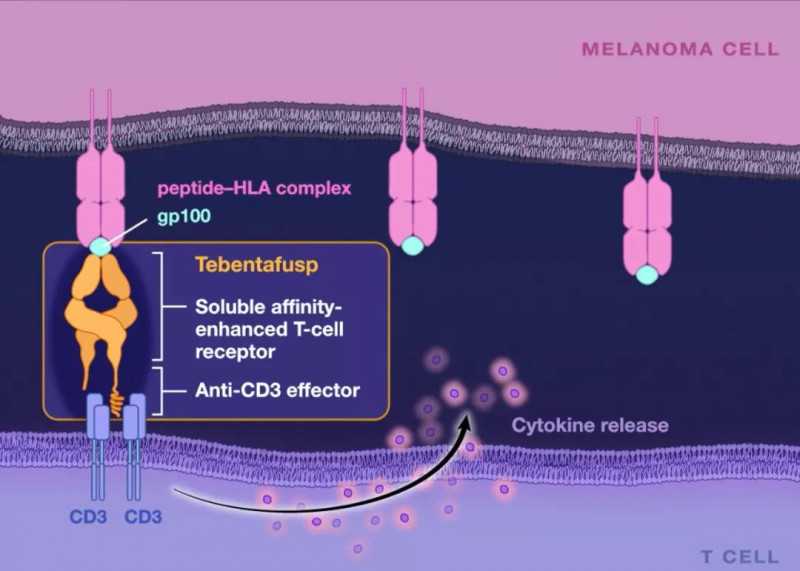
Kimmtrak的作用机制(来源:参考文献[3])
Kimmtrak的批准是基于3期临床试验的结果。这项试验招募了以前没有接受过治疗的葡萄膜黑色素瘤患者,他们都是HLA-A*02:01阳性。患者以2: 1的比例被随机分为两组。前者用Kimmtrak治疗,后者用活性对照药物治疗。去年9月《新英格兰医学杂志》公布的数据显示,作为一线治疗,Kimmtrak降低了49%的患者死亡风险(HR=0.51,95% CI: 0.37,0.71)。Kimmtrak组的中位总生存期为21.7个月,而主动对照组的中位总生存期为16.0个月。在安全性方面,治疗相关不良事件是可控的。
Kimmtrak的3期临床试验总存活数据(来源:参考文献[3])
Immunocore的ImmTAC技术平台专注于开发一系列双特异性生物产品,使免疫系统能够重新识别并杀死癌细胞。Kimmtrak是第一个在这个平台上诞生的疗法。该平台上正在研究的其他分子也有类似的设计,它们通过转化可溶性T细胞受体来识别细胞内的癌抗原,并通过抗CD3免疫应答结构域高亲和力、高选择性地杀死这些癌细胞。由于T细胞具有浸润人类肿瘤的能力,在ImmTAC平台上诞生的分子具有靶向实体肿瘤的潜力,无需考虑肿瘤的突变负担。这些分子也有治疗血癌的潜力。
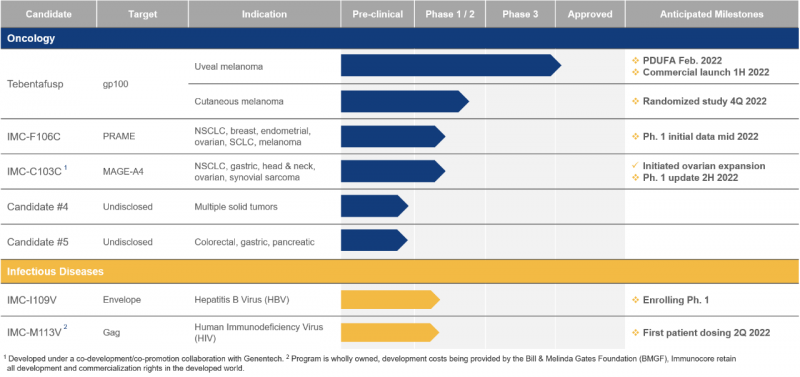
Immunocore的研发管道(来源:参考文献[4])
参考资料:
[1] Immunocore宣布FDA批准KIMMTRAK (tebentafusp-tebn)用于治疗不可切除或转移性葡萄膜黑色素瘤,检索于2022年1月26日,来自
[2]更新:美国食品和药物管理局加快批准世界上第一个TCR——经过14年的研发跋涉,于2022年1月26日从
[3]内森等,(2021)。替苯他福司治疗转移性葡萄膜黑色素瘤的总体生存获益。NEJM,DOI: 10.1056/NEJMoa2103485
[4]immuno core官方网站,2022年1月26日检索,来自
(原文已删除)
关注药明康德微信官方账号
