又是一年,ASCO。
在去年的ASCO上,时任FDA局长的Scott Gottlieb透露,FDA的子公司肿瘤学卓越中心(OCE)将颁布一项批准主要创新抗癌新药的新政策,即3354“RTOR实时肿瘤学评论”。接下来,我们来看看这个试点项目一年来取得了哪些进展。
7个肿瘤药物新适应症获批
这七种肿瘤药物中的大部分之前已经获得了优先评价和突破性治疗的资格。与FDA授予的其他资格不同,如果你想进入RTOR项目,你需要制药公司主动申请。目前只有大部分大型跨国药企敢尝试。FDA尚未公布进入RTOR试点项目的药物名单。仅根据公司公告就可以知道,目前已经有Genmab的daratumumab和让桑的apalutamide进入这个项目。
到目前为止,RTOR试点项目已经批准的药物
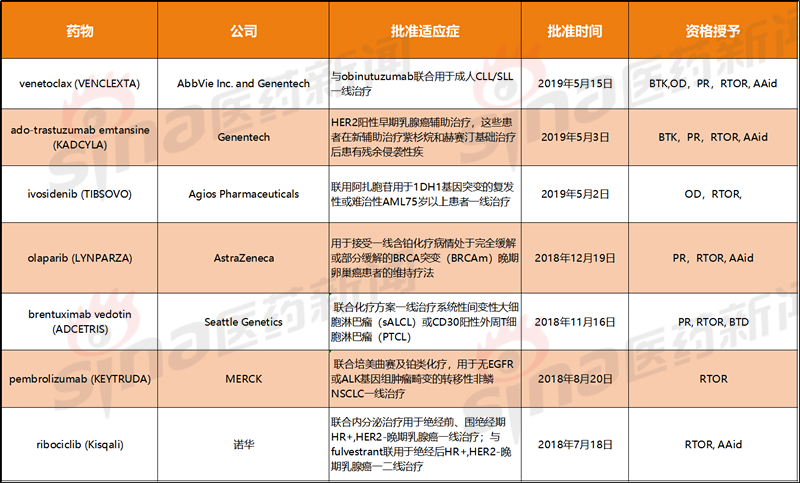
简称:BTK:突破性疗法鉴定;OD:孤儿药资质;PR:优先审查;AAid:评估援助
比优先审评更快的速度
优先评估和实时肿瘤评估(试点)都是加速评估。虽然约束更多,但求值速度更快。
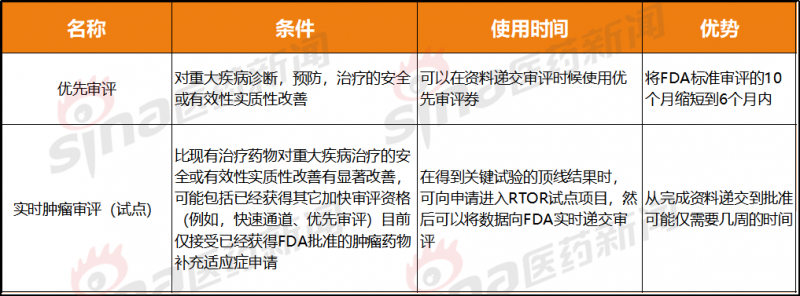
如果FDA认为制药公司的申请符合RTOR作为评估路径的要求,制药公司可以在临床试验数据库锁定后的2-4周内开始向FDA动态提交数据。

Ribociclib和Pembrolizumab的RTOR审查时间表
诺华ribociclib (Kisqali)是第一个申请RTOR试点项目的药物,它根据两个不同的III期试验提交了两个适应症的申请。
2018年4月6日,诺华和FDA开会讨论通过RTOR项目sNDA的可能性;从4月24日开始,逐步向FDA提交安全性和有效性数据、说明书、临床药理等内容;4-6月期间,FDA要求诺华提供更多信息和数据。在此过程中,双方每两周举行一次定期电话会议。6月28日,诺华提交了所有完整的资料。
直到FDA最终批准Kisqali的补充申请,整个过程比预设PDUFA的优先审查提前了近6个月。
同样,第二个进入RTOR试点项目的Pembrolizumab (Keytruda)最终获得批准,比预定的PDUFA优先审查时间提前了一个月。当然,药品最终获批并没有统一的时间要求。例如,brentuximab vedotin (ADCETRIS)在提交信息后不到2周内获得批准。
加入RTOR项目的重要条件
鉴于肿瘤治疗尚未满足的临床需求较高:多年来,外周T细胞淋巴瘤(PTCL),一种罕见且进展迅速的非霍奇金淋巴瘤,是联合化疗的唯一一线治疗方案,布伦妥昔单抗韦多汀提供了一种非化疗选择,并能带来长期缓解;Kisqali可用于绝经前、围绝经期和绝经后HR /HER2-乳腺癌,患者无需根据绝经的变化而更换药物。Venclexta和obinutuzumab的组合可以为CLL/SLL患者提供无化疗的治疗选择。
直接显示益处的试验设计:选择的终点基本上是OS或PFS。例如,Keytruda联合化疗在KEYNOTE-189试验的基础上被批准作为非小细胞肺癌的一线治疗。结果显示,与对照组相比,Keytruda的OS HR中位数为0.49,降低了51%的死亡风险。
能满足FDA的合作要求:一旦能进入RTOR项目,企业需要按照FDA的要求提供审查所需的资料,FDA会给予说明,批准概率基本100%。但是,最终药企要想早点上市,还是要做出快速反应的要求。西雅图基因首席执行官Clay Siegel曾表示,有时FDA经常要求在24小时内对Adcetris测试数据进行一些分析,这使得团队需要频繁加班,但最终,这是以在5周内完成预计3个月提交的申请为代价的。在所有数据提交后11天,FDA批准了Adcetris的新适应症。
RTOR未来的发展
RTOR不仅可以尽早获得对患者有效的药物,还可以在药物研发过程中更加合理地利用资源。对于监管者而言,早期获取安全性和有效性数据可以尽早控制治疗机会和风险;对于制药公司来说,它可以提高
为了简化评估的工作量,RTOR试点项目明确不接受仅在美国境外进行的研究,以及辅助性、新辅助性和预防性研究,伴随诊断试剂、包含化学、生产和控制配方变更的补充申请,以及在开始时包含药理学/毒理学数据的补充申请。然而,今年,在批准olaparib (LYNPARZA)的同时,FDA还批准了BRAC Analysis CDX测试(Myriad Genetic Laboratories,Inc .),用于同一临床试验SOLO-1(用于试验中进行前瞻性或回顾性测试,以确认携带有害或疑似有害生殖系或体细胞BRCA突变(gBRCAm或sBRCAm)的患者的状态)。或许,在未来,可以逐步扩大审批范围。
此外,尽管RTOR计划没有明确接受基于真实证据的申请(RWE),但关于当前FDA接受用于提交上市申请的RWE数据(支持监管申请的指南最近已发布),通过RTOR计划获得批准的机会可能会通过提供更多的RWE和/或生物标志物的探索性证据而提高。