看点:
本月,CDE已受理9种化学药一类创新药,1种化学药一类创新药已申请上市。
本月新增103个受理号,根据仿制药质量和疗效的一致性评价品种申报。
据药智数据库最新统计,2018年12月,CDE共受理新药注册申请722件,受理号(复审除外,截至2018年12月31日,下同)。
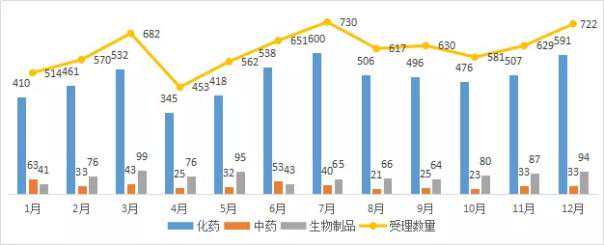
图1 2018年1-12月CDE药品受理情况
本月受理案件总数较11月有所增加。其中化学药品591件,中药33件,生物制品94件,体外诊断试剂4件。我们来分析一下化学药、中药、生物制品的注册、受理和评价。
一、化药审评情况
2018年12月,CDE共受理新化学药物注册申请591件,受理号为。
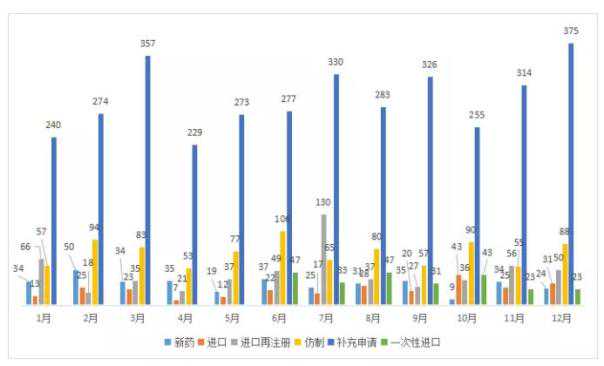
图2 2018年1-12月CDE化工受理情况
从新药申请情况来看,与11月相比,仿制和补充申请量略有增加,新药和进口再注册量有所下降,但仍明显高于11月。
1.第一类新化学药物的申报
本月,CDE共受理一类化学新药受理号24个,涉及9个品种、9家企业。下图是12月份新出的一类新药。
表1 2018年12月新承担的第一类化学药品

注:1。排队号截止到2019年1月4日。
迪哲(江苏)制药有限公司的一类新药AZD4205及其胶囊已获CDE批准临床应用。AZD4205是JD-1激酶1(JAK1)的选择性抑制剂,用于治疗非小细胞肺癌。迪哲(江苏)制药有限公司成立于2017年11月。阿斯利康携手先进制造基金,共同打造全球领先的创新型生物医药企业。作为SDIC创新与国际优势生物医药研究资源的独特创新合作模式,不仅能加速全球新药在中国上市,还能第一时间将全球最新药物带给中国患者,提高其临床效益。同时,可以依托全球优势创新资源,提升我国新药创制的核心竞争力,进入世界新药研发的前沿梯队,推动我国从制药大国向制药强国目标的实现。
上海简言新药R&D有限公司成立于2016年,是一家以国际医药市场需求为主导,以创新研究为基础的新型医药R&D企业。公司致力于研发具有全球自主知识产权的原创新药。YG1699是上海简言新药R&D有限公司自成立以来推出的新一代糖尿病药物产品。目前已完成专利转让,获得全球自主知识产权。YG1699是针对钠葡萄糖转运蛋白1/2(SGLT1/2)这一靶点开发的疗效高、副作用小、质量可控、具有创新性和自主知识产权的小分子双功能抑制剂。目前国际上发展最快的SGLT1/2小分子双功能抑制剂LX4211处于型糖尿病临床期,与胰岛素联合治疗的NDA申请也已在欧美提交。临床资料表明,SGLT1/2双功能抑制剂能有效降低餐后血糖和糖化血红蛋白,增加体内GLP-1和PYY,降低血压和体重,降低心血管疾病风险,并能有效避免主流降糖药物的毒副作用。它可用于伴有肾功能损害的II型糖尿病患者。
BPI-17509是贝达药业自主研发的成纤维细胞生长因子受体(FGFR1/2/3)新化学结构口服抑制剂。它旨在用于治疗具有FGFR基因融合突变或扩增的各种肿瘤。FGFR属于酪氨酸受体激酶家族,包括四种受体亚型(FGFR-1、2、3和4)和一些异构分子,在肿瘤增殖、血管生成、迁移和存活中起着至关重要的作用。已经发现不受控制的FGFRs信号
TT-00420是一种选择性聚焦激酶抑制剂,经过多轮结构优化后发现了一种全新的结构。它通过免疫调节和靶向抑制细胞周期的双重机制抑制肿瘤增殖。大量的临床前研究发现,TT-00420对恶性肿瘤,尤其是对三阴性乳腺癌移植瘤模型具有优异的抑制作用。目前,15%的乳腺癌患者属于三阴性乳腺癌,但该病尚无有效的靶向治疗方法,因此存在巨大的未满足的临床需求。2018年9月,自主研发的三阴性乳腺癌小分子新药TT-00420获得FDA批准进行临床试验。
MRX2843是Mer酪氨酸激酶(MerTK)和FMS样酪氨酸激酶3(FLT3)的双重抑制剂,具有新的化学结构。MerTK和FLT3在许多肿瘤中过度表达或突变。MRX2843可以通过抑制肿瘤微环境中肿瘤细胞和先天免疫细胞上的MerTK和FLT3,从而影响其关键的信号转导通路,从而影响肿瘤生长或通过免疫调节治疗肿瘤的能力。基于上述药物作用原理,MRX2843旨在用于治疗MerTK和FLT3途径异常的晚期实体瘤。2017年7月,贝达药业收购MRX-2843在中国的权益,负责MRX-2843在中国的R&D和申报。目前,世界上还没有同时针对MerTK和FLT3的临床或上市药物。
硝嗪是由暨南大学和广州喜鹊医药联合研制的化学新药。以川芎嗪为模型化合物,通过引入高效自由基清除基团,设计并合成了一种具有抗凝血和抗氧化作用的新化合物。在保持川芎嗪作用的同时,其更强的抗自由基能力可以增强脑卒中患者的脑细胞保护功能,减少脑缺血对细胞的损伤。我国是中风高发国家,缺血性中风药物市场巨大。然而,除了依达拉奉之外,临床上没有公认的抗自由药物。在保留活血化瘀中药的基础上,硝嗪具有很强的抗自由基作用,具有良好的市场前景。
丁医药新药尼泊甲苯磺酸雷帕利胶囊已获批准上市。对甲苯磺酸Nilaparib是一种PARP抑制剂,代号ZL-2306,英文名Nilaparib。2017年3月提交国内临床申请,同年7月临床获批。Nilaparib是FDA批准上市的第三个PARP抑制剂。此前,类似的药物阿斯利康的Olaparib和Clovis的Rucaparib已经上市,用于治疗BRCA变异型和复发性卵巢癌。Niraparib是第一个用于维持治疗的PARP抑制剂,即维持患者处于缓解状态。而Niraparib没有BRCA变异的限制,所以适用人群比前两种PARP抑制剂大。该产品已获准在香港上市,用于治疗卵巢癌,适用于含铂化疗后处于缓解期的患者,作为预防病情恶化的维持治疗。
2.第一类进口化学药品的申报。
本月受理了5个一类进口化学药品的受理号。
表2 2018年12月新签约第一类进口化学药品
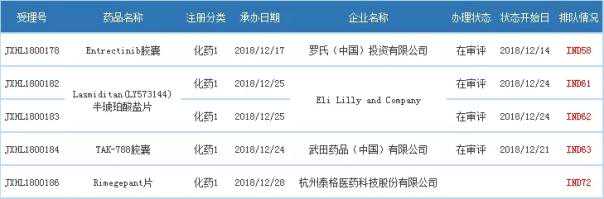
注:1。排队号截止到2019年1月4日。
二、中药审评情况
十二月,CDE共处理33项新的中药注册申请,包括32项补充申请和1项一次性进口申请。
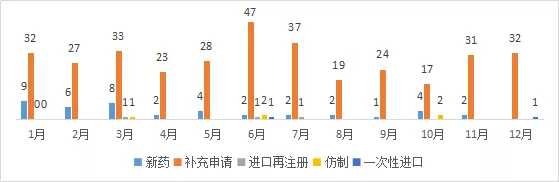
图3 2018年1-12月CDE中医药受理情况
三、生物制品审评情况
12月,CDE处理了94项新的生物制品注册申请、10项新药物、52项补充申请、28项进口、3项进口再注册和1项一次性进口。
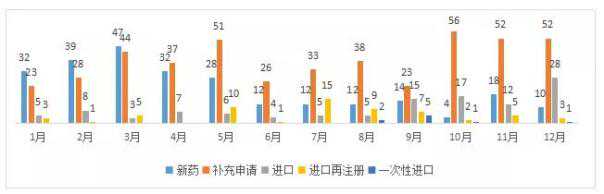
图4 2018年1-12月CDE生物制品受理情况
四、本月批准临床/上市的新药信息
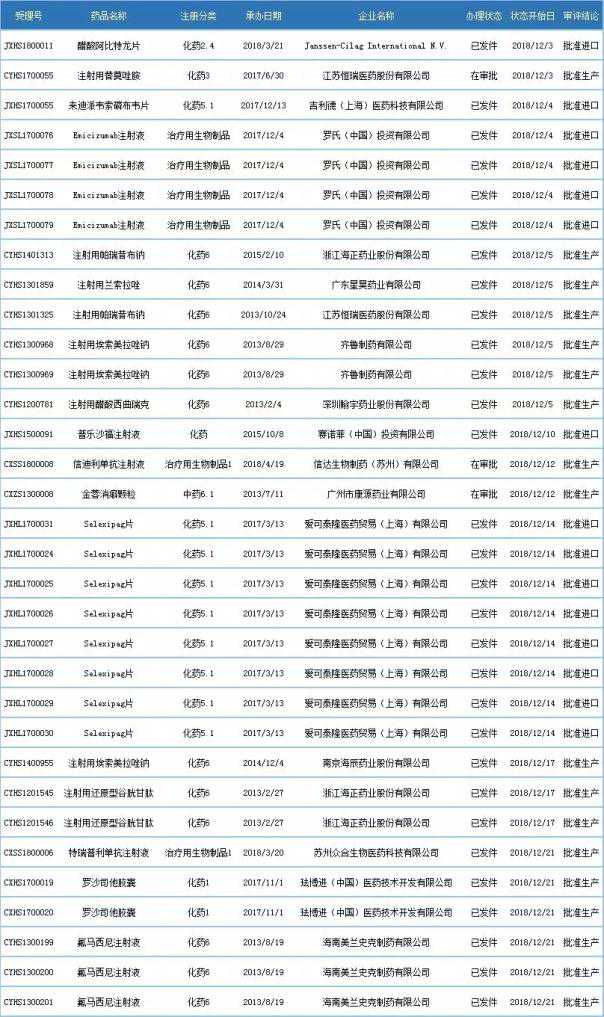
表3 2018年12月批准临床/上市的新药
五、按一致性评价申报受理情况
2018年5月以来,按照一致性评价申报的受理案例大幅增加,至9月基本持平,12月再创新高,新增按照一致性评价要求申报的受理案例103件。

图5 2018年1月至12月合格评定申请受理情况
注:以上文章所发表内容的知识产权属于