陈文达
2019年,国家美国食品药品监督管理局批准上市的新药中,62.3%的新药通过优先审评审批渠道获得批准上市。“优先审查”制度在推动新药上市方面发挥了重要作用。
优先审评相关政策发展
NMPA出台了很多加快药品审评的政策,比如2005年的“专项审评”,2006年的“重大项目”,2009年鼓励创新药的“特批”,而优先审评是2015年才成型的。
2015年2月30日,国家美国食品药品监督管理局发布《国家食品药品监督管理总局关于药品注册审评审批若干政策的公告 (2015 年第 230 号)》,规定了八种情况可以进行“加速审批”;
2016年2月26日,中国食品药品监督管理局发布《关于解决药品注册申请积压实行优先审评审批的意见》,标志着“优先审查”制度正式政策落地;
2017年12月18日,总局发布《总局关于鼓励药品创新实行优先审评审批的意见》,将“优先审评”从解决药品审批积压转向鼓励更多创新药物研发;
2019年11月8日,国家医药产品管理局药品审评中心在中心网站公示《优先审评审批工作程序》(征求意见稿),审评时限再次明显缩短。纳入优先审评审批程序的药品上市注册申请审评时限为120天,其中临床急需的境外上市罕见病药品审评时限为60天。
优先审评上市的新药类型
截至2020年2月24日,已有36个化学新药和27个生物新品通过优先评价方式上市。
从药种占比来看,获得优先审评上市的国产和进口新药主要是化学药,国产新药和生物药占比本来就低。得益于2019年4个具有“重大专项”资质的生物相似药优先审评上市,生物药占比可达40%。
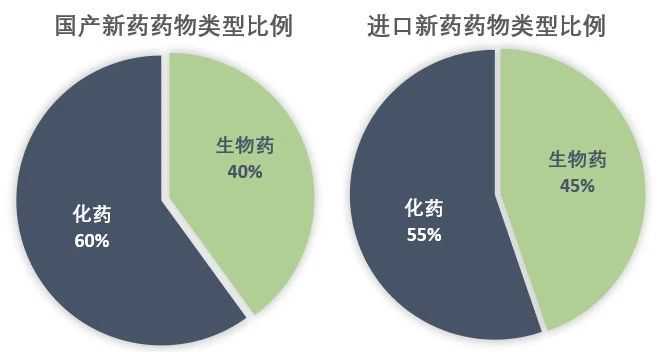
图1国产(左)和进口(右)新药类型的比例
从适应症分布来看(疫苗类产品除外),优先审评上市的国产新药适应症以肿瘤为主,其次是以丙型肝炎为主的感染性疾病,而通过优先审评上市的进口新药适应症以肿瘤为主,但比例低于国产新药,还包括其他临床急需的罕见病、眼科用药等治疗优势明显的新药。
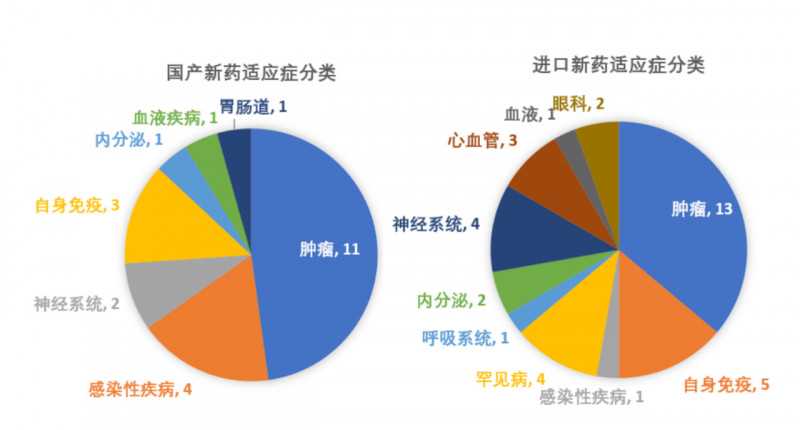
图2国产新药适应症中肿瘤比例高于进口新药。
从审批时间来看,国产新药从宣布获得优先审评资格到获得NMPA批准的天数中位数为406天。最快的是康赛诺生物的重组埃博拉病毒疫苗,历时142天,而进口新药的天数中位数为216天。其中,默沙东的9价HPV疫苗Gardasil 9从CDE被列入第28批优先审评目录到获批上市,仅用了破纪录的5天时间。
获益于优先审评的新药企业
从药企来看,新药受益于“优先审评”上市的外资跨国药企和本土药企数量各占一半左右。但从每家企业通过审核的数量来看,外资跨国药企受益更多,因为平均获批上市的新药数量更多。
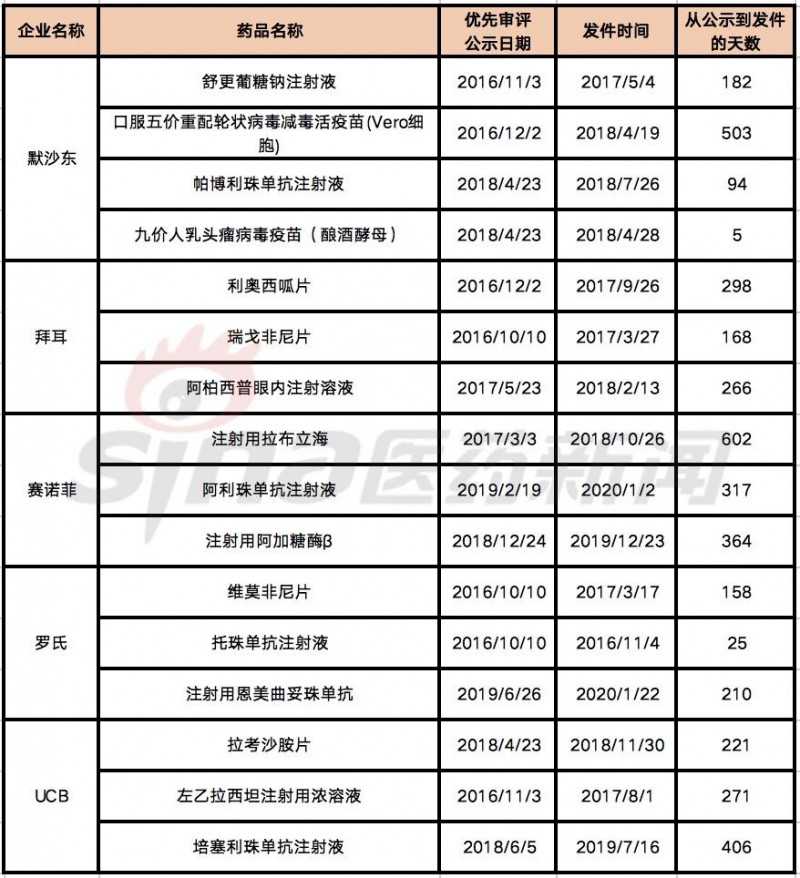
在通过优先评价上市的五种新药中,莫东名列第一。除了两个疫苗产品,著名的抗PD-1抗体Pabolizumab,还有全球首个上市的舒更葡萄糖钠注射液,用于逆转神经肌肉阻断剂的选择性肌肉松弛拮抗剂。在临床麻醉中,可以帮助全麻患者准确、快速地逆转深、中度肌肉松弛,促进自主呼吸和肢体活动能力,有助于改善术后效果。
拜耳、赛诺菲、罗氏和育碧分别有三个产品获得上市优先审查。
表1上市申请最优先审查的跨国制药公司
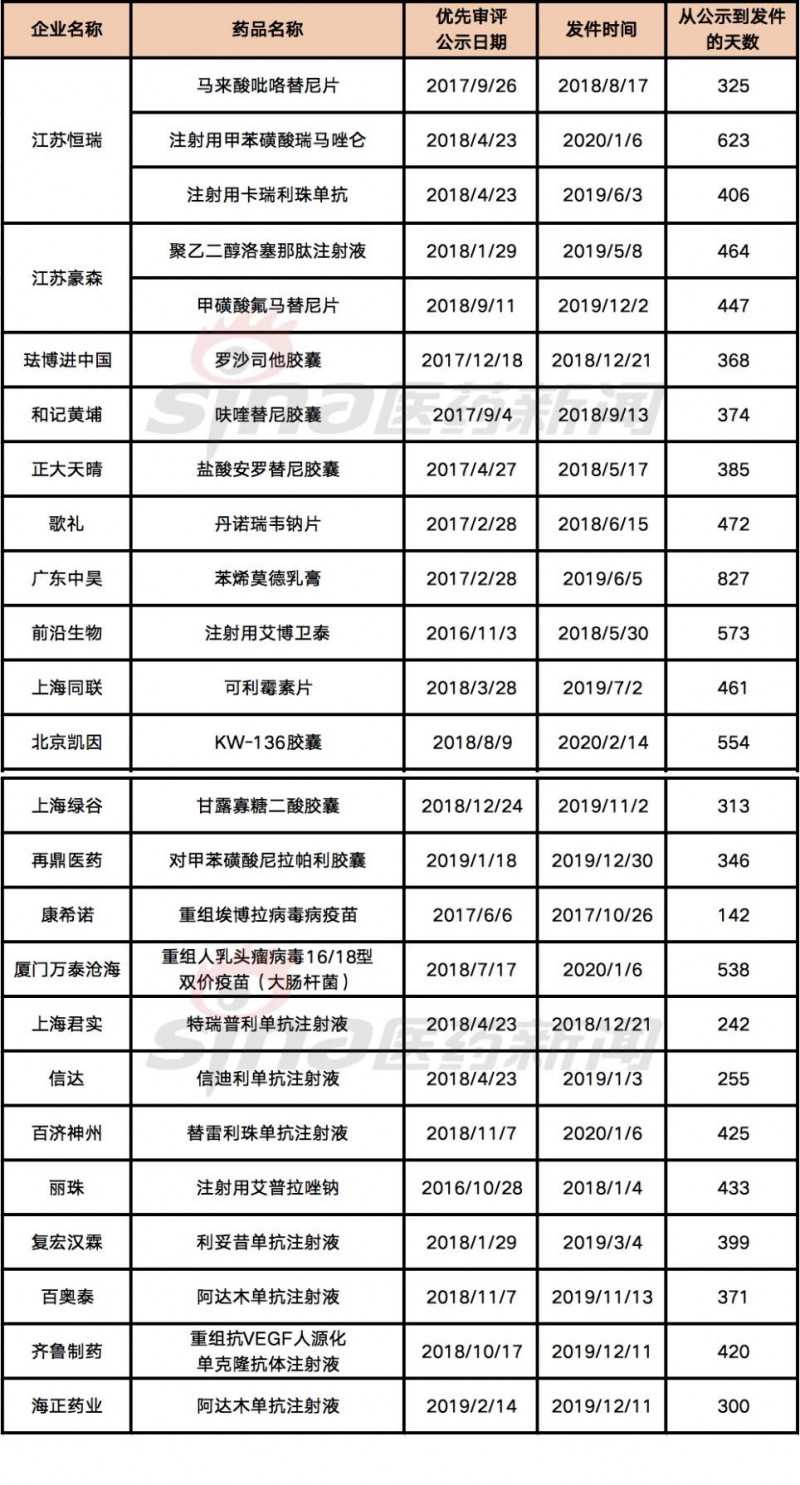
除了新药R&D布局较早的江苏恒瑞、江苏豪森等本土药企外,已有三两个新药通过优先评审上市,不少创新企业在新药方面取得了多项国内“第一”突破。例如,哈奇斯公司的创新药物
表2上市申请已获优先审核的本地制药公司
1.Pharmadigger数据库
2.国家药品审评中心的“优先审评公示”